
分析 (1)已知100℃时,KW=1.0×10-12.将一定体积pH=10的NaOH溶液和一定体积的pH=3的H2SO4溶液混合,所得混合溶液pH=7,说明溶液显碱性,c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$=10-5mol/L,设氢氧化钠溶液体积为V1,硫酸溶液体积V2,根据$\frac{1×1{0}^{-2}×{V}_{1}-1×1{0}^{-3}×{V}_{2}}{{V}_{1}+{V}_{2}}$=10-5计算氢氧化钠和硫酸的体积之比;
(2)根据氨水的电离平衡常数Kb=$\frac{[N{{H}_{4}}^{+}][O{H}^{-}]}{[N{H}_{3}•{H}_{2}O]}$代入数据进行计算即可;
(3)醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,醋酸电离产生的醋酸根离子和氢离子数目增多浓度减小,根据醋酸的电离程度确定溶液中微粒个数变化;
(4)燃料电池中,负极是燃料发生失电子的氧化反应.
解答 解:(1)已知100℃时,KW=1.0×10-12.将一定体积pH=10的NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-10}}$=10-2mol/L,一定体积的pH=3的H2SO4溶液中c(H+)=10-3mol/L,二者混合,所得混合溶液pH=7,说明溶液显碱性,c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$=10-5mol/L,设氢氧化钠溶液体积为V1,硫酸溶液体积V2,根据c(OH-)=$\frac{1×1{0}^{-2}×{V}_{1}-1×1{0}^{-3}×{V}_{2}}{{V}_{1}+{V}_{2}}$=10-5计算得到溶液体积之比,V1:V2=101:999
故答案为:101:999;
(2)0.05mol•L-1(NH4)2SO4溶液的pH=a,则c(OH-)=10a-14,Kb=$\frac{[N{{H}_{4}}^{+}][O{H}^{-}]}{[N{H}_{3}•{H}_{2}O]}$=1.7×10-3mol.L-1,所以$\frac{[N{{H}_{4}}^{+}]}{[N{H}_{3}•{H}_{2}O]}$=$\frac{1.7×1{0}^{-3}}{1×1{0}^{a-14}}$=1.7×1011-a,故答案为:1.7×1011-a;
故答案为:1.7×1011-a;
(3)A、醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,醋酸电离产生的醋酸根离子和氢离子数目增多,即溶液中导电粒子的数目将增多,故A错误;
B、加水稀释,促进电离,但离子浓度降低,酸性减弱,对水的电离的抑制程度减弱,即由水电离的c(H+)浓度将增大,故B正确;
C、溶液中$\frac{[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH][O{H}^{-}]}$=$\frac{Ka}{Kw}$=常数,只受温度的影响,所以加水后数值不变,故C正确;
D、醋酸电离产生的醋酸根离子和氢离子数目增多,浓度同等程度的减小,$\frac{[C{H}_{3}CO{O}^{-}]}{[{H}^{+}]}$将不变,故D错误;
E、加水稀释,醋酸的电离程度将增大,c(H+)减小,故E错误.
故选BC;
(4)燃料电池中,负极是燃料发生失电子的氧化反应,所以氨作为燃料电池燃气时,负极上是氨气失电子的过程,即2NH3-6e-+6OH-=N2+6H2O,故答案为:2NH3-6e-+6OH-=N2+6H2O.
点评 本题考查了弱电解质的电离、酸碱混合后溶液pH的计算等知识,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法是关键,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,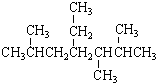 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,邻二甲苯、间二甲苯、对二甲苯的沸点依次增大 | |
| C. | 已知1mol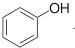 可以与1molNaOH发生反应.则1mol 可以与1molNaOH发生反应.则1mol 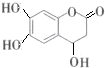 与足量的NaOH溶液发生反应时,需消耗4molNaOH 与足量的NaOH溶液发生反应时,需消耗4molNaOH | |
| D. | 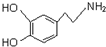 属于氨基酸,既能与强酸反应,又能与强碱反应 属于氨基酸,既能与强酸反应,又能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ②③ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
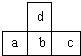 如图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法不正确的是( )
如图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法不正确的是( )| A. | a、b、c的最高价氧化物对应水化物的酸性强弱的关系是c>b>a | |
| B. | d的氢化物比b的氢化物稳定 | |
| C. | d与c不能形成化合物 | |
| D. | 原子半径的大小顺序是a>b>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 左盘上升 | B. | 右盘下沉 | C. | 仍保持平衡 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com