
【题目】某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.
实验步骤如下:①按如图所示的装置连接好仪器;②检查装置的气密性;③在装置A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞;④待烧瓶a中气体收集满后,向烧杯中加水,挤压预先盛有水的胶头滴管,观察实验现象.
请回答下列问题:
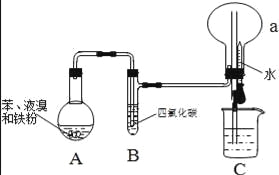
(1)装置A中发生反应的化学方程式为![]() .
.
(2)能证明装置A中发生的反应为取代反应的实验现象是
(3)装置B的作用是 .
(4)为除去溴苯中混有的少量溴,常向混合物中加入的试剂是 (填化学式),充分振荡,静置后再 (填操作名称).
【答案】(1)![]() ;
;
(2)a中发生喷泉现象;
(3)除去未反应的苯蒸气和溴蒸气;
(4)NaOH;分液.
【解析】试题分析:(1)苯与液溴在铁做催化剂条件下反应生成溴苯和溴化氢;
(2)苯与溴在溴化铁做催化剂的条件下生成溴苯和溴化氢,生成的溴化氢极易溶于水,所以C中产生“喷泉”现象,即可证明发生取代反应,若发生加成反应,则不会生成溴化氢,不会产生喷泉;
(3)由于反应放热,苯和液溴均易挥发,溴的存在干扰检验H+和Br﹣;
(4)溴与氢氧化钠反应生成易溶于水的溴化钠,溴苯不溶于水,据此选择分离方法.
解:(1)苯与溴在溴化铁做催化剂的条件下生成溴苯和溴化氢,苯分子里的氢原子被溴原子所代替,方程式为![]() ;
;
故答案为:![]() ;
;
(2)苯与溴在溴化铁做催化剂的条件下生成溴苯和溴化氢,生成的溴化氢极易溶于水,所以C中产生“喷泉”现象,即可证明发生取代反应,若发生加成反应,则不会生成溴化氢,不会产生喷泉;
故答案为:a中发生喷泉现象;
(3)由于反应放热,苯和液溴均易挥发,苯和溴极易溶于四氯化碳,用四氯化碳除去溴化氢气体中的溴蒸气和苯,以防干扰检验H+和Br﹣,
故答案为:除去未反应的苯蒸气和溴蒸气;
(4)溴苯中混有的少量溴,常向混合物中加入的试剂是氢氧化钠,化学式为NaOH,溴与氢氧化钠反应生成溶于水的溴化钠,溴苯不溶于水,产生分层,可以用分液漏斗分离;
故答案为:NaOH;分液.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,并回答下列问题:
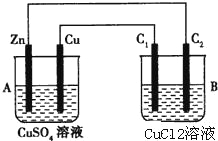
(1)判断装置的名称:A池为 ,B池为 .
(2)锌棒上发生 反应,电极反应式为 ;铜棒上的现象是 ,电极反应式为 ;石墨棒C1上发生的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图均为实验过程中产生沉淀的物质的量(Y)与加入试剂的量(X)之间的关系图,其中正确的是
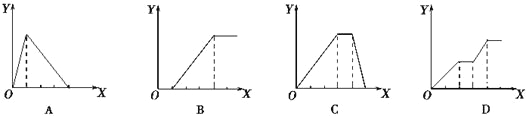
A. 图①:向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B. 图②:向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
C. 图③:向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量
D. 图④:向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知下列反应的能量变化示意图如下,下列有关说法正确的是( )
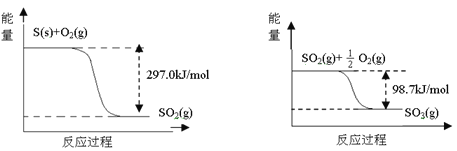
A.1molS(g)与O2(g)完全反应生成SO2(g),反应放出的热量<297.0kJ
B.在相同条件下,SO3(g)比SO2(g)稳定
C.1molSO2(g)和1/2molO2(g)生成1molSO3(l)放出98.7kJ的热量
D.由图得S(s)+3/2O2(g)![]() SO3(g) △H=-198.3kJ/mol
SO3(g) △H=-198.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由氯苯制取1,2,3,4﹣四氯己烷,步骤如下:
(1)写出A、B、C的结构简式A B .
(2)填写每步所属的反应类型(a.取代反应;b.加成反应;c.消去反应,只须填写字母):③ .
(3)反应②所需要的试剂和条件是
(4)反应④的化学方程式为④ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关甲烷的说法中错误的是
A.采煤矿井中的甲烷气体是植物残体经微生物发酵而来的
B.天然气的主要成分是甲烷
C.甲烷是没有颜色、没有气味的气体,极易溶于水
D.甲烷与氯气发生取代反应所生成的产物四氯甲烷是一种效率较高的灭火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)![]() 4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe + 4NaOH
4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe + 4NaOH![]() Fe3O4 + 2H2↑ + 4Na↑。下列有关说法正确的是( )
Fe3O4 + 2H2↑ + 4Na↑。下列有关说法正确的是( )

A. 电解熔融氢氧化钠制钠,阳极发生电解反应2OH--2e-===H2↑+O2↑
B. 盖·吕萨克法制钠原理是利用铁的还原性比钠强
C. 若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数不同
D. 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阴极,铁为阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH = -92.2kJmol—1,测得0到10秒内,c(H2)减小了0.75molL—1,下列说法正确的是( )
2NH3(g) ΔH = -92.2kJmol—1,测得0到10秒内,c(H2)减小了0.75molL—1,下列说法正确的是( )
A.10到15秒内c(NH3) 增加量等于0.25mol L—1
B.10秒内氨气的平均反应速率为0.025molL—1·s—1
C.达平衡后,分离出少量NH3,v正 增大
D.该反应的逆反应的活化能不小于92.2kJmol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组物质中含有的化学键类型相同的是
A. NaCl、HCl、H2O、NaOH B. Cl2、Na2S、HCl、SO2
C. HBr、CO2、H2O、CS2 D. Na2O2、H2O2、H2O、O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com