
 ,则其在周期表中的位置是第四周期,第ⅤA族.
,则其在周期表中的位置是第四周期,第ⅤA族.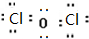 ;
;分析 (1)周期数等于电子层数,主族充数等于最外层电子数;
(2)酸酐与对应酸中Cl元素的化合价相同,Cl2O的结构为Cl-O-Cl,其电子式为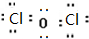 ;
;
a.氧化氯的分子式中O为负价,则非金属性O大于Cl;
b.与金属反应得电子的数目,不能比较非金属性;
c.气态氢化物的稳定性强的为水,则非金属性O大于Cl;
d.O元素不存在最高价氧化物对应水化物;
(3)请根据周期表中第三周期元素相关知识回答:氧化性最弱的简单阳离子是金属最强的原子对应的离子;
a.同一周期,随着原子序数的增大,原子半径逐渐减小,简单离子半径先减小后增大再减小;
b.同一周期元素,随着原子序数的增大,元素的金属性逐渐减弱,非金属性逐渐增强;
c.同一周期元素,其单质的熔点先增大后减小;
d.元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
解答 解:(1)As的原子结构示意图为 ,四个周期,最外层5个电子,所以是第四周期,第ⅤA族,故答案为:第四周期,第ⅤA族;
,四个周期,最外层5个电子,所以是第四周期,第ⅤA族,故答案为:第四周期,第ⅤA族;
(2)酸酐与对应酸中Cl元素的化合价相同,则Cl2O是为HClO的酸酐,Cl2O的结构为Cl-O-Cl,其电子式为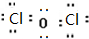 ,
,
a.氧化氯的分子式中O为负价,则非金属性O大于Cl,故正确;
b.与金属反应得电子的数目,不能比较非金属性,故错误;
c.气态氢化物的稳定性强的为水,则非金属性O大于Cl,故正确;
d.O元素不存在最高价氧化物对应水化物,故错误;
故答案为:HClO;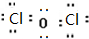 ;ac;
;ac;
(3)请根据周期表中第三周期元素相关知识回答:氧化性最弱的简单阳离子是金属最强的原子对应的离子,所以是钠离子;
a.第三周期中,随着原子序数的递增,原子半径逐渐减小,而离子半径需要根据阴阳离子进行讨论,阳离子只有2个电子层,随着核电荷数在增大,半径逐渐减小,而阴离子有3个电子层,随着核电荷数的增加逐渐减小,但是阴离子半径整体大于阳离子半径,从阳离子到阴离子,半径在增大,故a错误;
b.同一周期中,随着核电荷数的递增,元素的金属性逐渐减弱,非金属性逐渐增强,故b正确;
c.同一周期元素,其单质的熔点先增大后减小,Si的熔点最高,故c错误;
d.元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以其最高价氧化物的水化物碱性减弱、酸性增强,故d错误;
故答案为:Na+;b.
点评 本题考查较综合,涉及同一周期中元素周期律与原子结构的关系、电子式的书写等知识,注重高频考点的考查,题目难度较大,有利于培养学生的分析、理解能力及灵活应用所学知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 实验组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2.0mL | 20 | / |
| Ⅱ | 2.0mL | 20 | 少量MnSO4粉末 |
| Ⅲ | 2.0mL | 30 | / |
| Ⅳ | 1.0mL | 20 | 1.0mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

实验 记录 | ①Zn质量减少,Cu质量不变; ②外电路电流方向是:由Cu→Zn; ③SO42- 向Cu极移动; ④Zn电极发生氧化反应; ⑤正极反应式:Cu2++2e-═Cu |
| A. | ①②④ | B. | ②③④ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | Mg、Al与同浓度盐酸反应,Mg更剧烈 | ||
| C. | 稳定性:HBr>HI | D. | 酸性:H3PO4>HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验Fe2O3中是否含有FeO | 向少量固体样品中加入适量稀硝酸溶解后,再滴加少量的高锰酸钾溶解 |
| B | 测定NaHCO3和NH4Cl固体混合物中NaHCO3 的质量分数 | 准确称取ag样品和坩埚总质量,加强热后在空 气中冷却至室温,再称量得到总质量为bg |
| C | 探究温度对化学平衡的影响 | 把装有颜色相同的NO2和N2O4混合气体的两支试管(密封)分别浸入冷水和热水中 |
| D | 除去CO2气体中混有的少量HCl气体 | 将混合气体依次通过盛有饱和Na2CO3溶液和浓H2SO4的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-═Cu2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
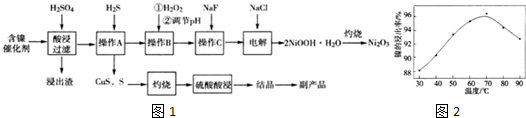
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH02 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的氢化物的沸点比D的氢化物要高,原因是B的非金属性强 | |
| B. | 比较A、C元素形成的常见氧化物,它们的化学键类型相同,晶体类型也相同 | |
| C. | C的最高价氧化物的水化物酸性比D的最高价氧化物的水化物酸性强 | |
| D. | 根据元素周期律,推测E在氧气中燃烧时可能生成E2O2、EO2等物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com