
�ճ�����ˮ��NO3һ�ĺ�����ˮ�������������Ҫ��֮һ���ﵽһ��Ũ��ʱ������ཡ������Σ����Ϊ�˽�������ˮ��NO3һ��Ũ�ȣ�ij��ȤС��������·�����
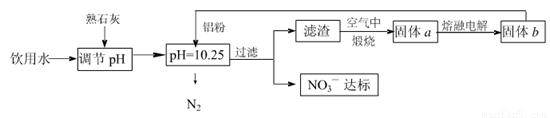
��ش��������⣺
��1���÷����ڵ���pHʱ����pH������С������� �������ʽ��͡�
��2����֪���˺�õ�����Һ�м���������Ԫ�ء�������Һ�����ۺ�NO3һ��Ӧ�����ӷ���ʽΪ ��
�������ڿ��������չ������漰����ط�Ӧ����ʽΪ
��3����H2����ԭ��Ҳ�ɽ�������ˮ��NO3����Ũ�ȣ���֪��Ӧ�еĻ�ԭ���������������ɲ������ѭ���������ԭ�������ӷ���ʽΪ ��
��4������ˮ�е�NO3�� ��Ҫ������NH4������֪�����������£�NH4�� ����������Ӧ��������NO3�� ��������Ӧ�������仯ʾ��ͼ���£�


��д��1 mol NH4�� (aq)ȫ��������NO3�� (aq)���Ȼ�ѧ����ʽ�� ��
��5������a���ڵ��ʱ������ӦʽΪ
��1��������Al��(2��)
��2����10Al+6NO3��+18H2O��10Al(OH)3��+3N2��+6OH��(2��)
��4Al+ 3O2 2 Al2 O3
2Al(OH)3
2 Al2 O3
2Al(OH)3 Al2 O3+3 H2O����2�֣�
Al2 O3+3 H2O����2�֣�
��3��5H2+2NO3��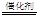 N2��+4H2O+2OH��
(2��)
N2��+4H2O+2OH��
(2��)
����5H2+2NO3����2H��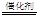 N2��+6H2O��
N2��+6H2O��
��4��NH4�� (aq)��2O2(g)��2H��(aq)��NO3�� (aq)��H2O(l) ��H����346 kJ��mol��1(2��)
��5��Al3++3e-= Al��2�֣�
��������
�����������1���������ܺ�����ܷ�Ӧ���÷����ڵ���pHʱ����pH������С�������������Al�� �������ʽ��͡���2������������������ӷ���������ԭ��Ӧ���ɹ��壬�����Ϊ���������������ᱻ��ԭΪ������������Һ�����ۺ�NO3����Ӧ�����ӷ���ʽΪ10Al+6NO3��+18H2O=10Al��OH��3+3N2��+6OH�����������ڿ��������չ������漰����ط�Ӧ����ʽΪ4Al+ 3O2 2 Al2 O3 ��2Al(OH)3
2 Al2 O3 ��2Al(OH)3 Al2 O3+3 H2O����3��H2����ԭ����ˮ��NO3������Ӧ�еĻ�ԭ���������������ɲ������ѭ���������Ϊˮ�͵������÷�ӦΪ5H2+2NO3��
Al2 O3+3 H2O����3��H2����ԭ����ˮ��NO3������Ӧ�еĻ�ԭ���������������ɲ������ѭ���������Ϊˮ�͵������÷�ӦΪ5H2+2NO3�� N2+4H2O+2OH������4����ͼ��֪����һ���Ȼ�ѧ��ӦΪNH4+ ��aq��+1.5O2��g��=2H+��aq��+NO2�� ��aq��+H2O��l����H=��2736 kJ•mol��1�٣��ڶ����Ȼ�ѧ��ӦΪNO2�� ��aq��+0.5O2��g��=NO3�� ��aq������H=��73kJ•mol��1�ڣ��ɸ�˹���ɿ�֪��+�ڵ�1mol NH4+��aq��ȫ��������NO3�� ��aq�����Ȼ�ѧ����ʽΪNH4+
��aq��+2O2��g��=2H+��aq��+NO3�� ��aq��+H2O��l����H=��346 kJ•mol��1����5������a���ڵ��ʱ����������ӵģ���ӦʽΪAl3++3e-=
Al��
N2+4H2O+2OH������4����ͼ��֪����һ���Ȼ�ѧ��ӦΪNH4+ ��aq��+1.5O2��g��=2H+��aq��+NO2�� ��aq��+H2O��l����H=��2736 kJ•mol��1�٣��ڶ����Ȼ�ѧ��ӦΪNO2�� ��aq��+0.5O2��g��=NO3�� ��aq������H=��73kJ•mol��1�ڣ��ɸ�˹���ɿ�֪��+�ڵ�1mol NH4+��aq��ȫ��������NO3�� ��aq�����Ȼ�ѧ����ʽΪNH4+
��aq��+2O2��g��=2H+��aq��+NO3�� ��aq��+H2O��l����H=��346 kJ•mol��1����5������a���ڵ��ʱ����������ӵģ���ӦʽΪAl3++3e-=
Al��
���㣺��������Ϣ����ʽ����������ԭ��Ӧ�����ӷ�Ӧ���Ȼ�ѧ��Ӧ��ע�ضԻ�ѧ����Ŀ��飬ע��֪ʶ����Ŀ��Ϣ�Ľ������𣬶�ѧ������Ҫ��ϸߡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com