
| A、铝溶解在NaOH溶液中:2Al+2OH-=2AlO2-+3H2↑ |
| B、醋酸溶液滴入NaHCO3溶液中:H++HCO3-=CO2↑+H2O |
| C、SO2通入溴水中:SO2+Br2+H2O=SO42-+2Br-+2H+ |
| D、少量铁溶于过量稀硝酸中:Fe+4H++NO3-=Fe3++NO↑+2H2O |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
| A、不同条件下,1mol任何气体所含分子个数均相同 |
| B、1mol任何气体的体积均为22.4L |
| C、1mol气体在压强一定时,50℃时体积比20℃时体积大 |
| D、1LO2和1LO3在同温同压下具有相同数目的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
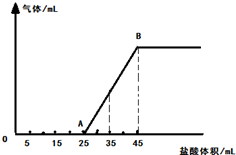 将一定量的NaOH、NaHCO3和Na2CO3三种溶液混合,向混合液中逐渐滴滴加一定浓度的稀盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示:
将一定量的NaOH、NaHCO3和Na2CO3三种溶液混合,向混合液中逐渐滴滴加一定浓度的稀盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
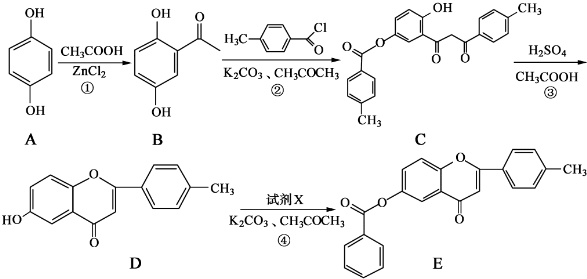

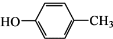 和CH3COOH为原料制备
和CH3COOH为原料制备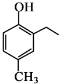 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度 | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com