
| A. | 2.8mol/L | B. | 3.0mol/L | C. | 3.2mol/L | D. | 3.6mol/L |
分析 将Cu2O拆分为Cu、CuO,原混合物看做Cu、CuO的混合物,其中一份用足量的氢气还原,反应后固体质量减少6.40g为拆分后Cu、CuO的混合物中O元素的质量,O原子的物质的量为:$\frac{6.4g}{16g/mol}$=0.4mol,根据Cu元素守恒可知:n(CuO)=n(O)=0.4mol;
另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,且同时收集到标准状况下NO气体4.48L,NO的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=3n(NO),由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu),根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2],据此计算n(HNO3),再根据c=$\frac{n}{V}$计算硝酸的浓度.
解答 解:将Cu2O拆分为Cu、CuO,原混合物看做Cu、CuO的混合物,其中一份用足量的氢气还原,反应后固体质量减少6.40g为拆分后Cu、CuO的混合物中O元素的质量,O原子的物质的量为:$\frac{6.4g}{16g/mol}$=0.4mol,根据Cu元素守恒可知n(CuO)=n(O)=0.4mol;
另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,且同时收集到标准状况下NO气体4.48L,NO的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=3n(NO)=3×0.2mol,n(Cu)=0.3mol,由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu)=0.4mol+0.3mol=0.7mol,根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2]=0.2mol+2×0.7mol=1.6mol,硝酸的浓度为:$\frac{1.6mol}{0.5L}$=3.2mol/L,
故选B.
点评 本题考查混合物的计算、守恒计算等,题目难度中等,明确反应过程是解题的关键,本题采取拆分法解答,简化计算过程,注意在学习中归纳总结.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 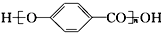 的结构中含有酯基 的结构中含有酯基 | |
| B. | 2-丁烯和 1-丁烯的加氢产物不同 | |
| C. | 1 mol 葡萄糖可水解生成 2 mol 乳酸(C3H6O3) | |
| D. | 油脂和蛋白质都是能发生水解反应的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3CH2)2CHCH3的系统命名是2-乙基丁烷 | |
| B. | 葡萄糖在不同的条件下可以发生取代、加成、消去、氧化、还原、酯化反应 | |
| C. | 有机同系物具有相同的通式,且组成相差n个CH2,因此等质量的同系物完全燃烧耗氧相差物质的量为1.5nmol | |
| D. | 分离乙酸乙酯、乙酸、乙醇的混和物流程如下: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图,曲线表示在800°C时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图象,试回答:
如图,曲线表示在800°C时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图象,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3•H2O+H2O | |
| B. | H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2 | |
| C. | 0.1mol/L CuCl2溶液中加入0.1mol/L NaHS溶液:Cu2++2HS-+2H2O=Cu(OH)2↓+2H2S↑ | |
| D. | 用石墨作电极电解AlCl3溶液:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质性质 | 甲 | 乙 | 丙 | 丁 |
| 熔点 | 低 | 高 | 高 | 低 |
| 水溶性 | 不溶 | 溶 | 不溶 | 溶 |
| 高温 | 分解 | 稳定 | 稳定 | 稳定 |
| 导电性 | 不导电 | 导电 | 不导电 | 导电 |
| A. | 甲 | B. | 乙 | C. | 丙 | D. | 丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| B. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 | |
| D. | 蛋白质和油脂都是能发生水解反应的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
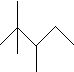 ,有机物B与等物质的量的H2发生加成反应可得到A,下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到A,下列有关说法错误的是( )| A. | A的最简式为C4H9 | |
| B. | A的一氯代物有5种 | |
| C. | A有许多同分异构体,其中主链碳数为5有机物有5种(不包括A) | |
| D. | B的结构可能有3种,其中一种名称为:2,2,3-三甲基-3-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
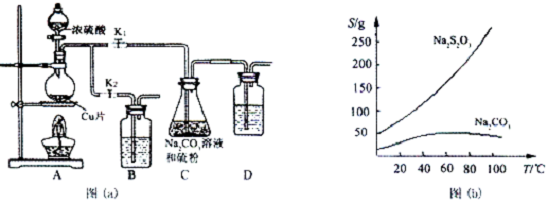
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com