
 PbO2+Pb+2H2SO4,则该铅蓄电池在充电时阳极的电极反应式:PbSO4-2e-+2H2O═PbO2+SO42-+4H+.
PbO2+Pb+2H2SO4,则该铅蓄电池在充电时阳极的电极反应式:PbSO4-2e-+2H2O═PbO2+SO42-+4H+. 分析 充电时电池总反应式为:2PbSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$PbO2+Pb+2H2SO4,阳极上发生氧化反应,阴极上发生还原反应:PbSO4+2e-=Pb+SO42-,总反应式减去阴极反应式可得阳极电极反应式.
解答 解:充电时电池总反应式为:2PbSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$PbO2+Pb+2H2SO4,阳极上发生氧化反应,阴极上发生还原反应,阴极电极反应式:PbSO4+2e-=Pb+SO42-,总反应式减去阴极反应式可得阳极电极反应式,故阳极电极反应式为:PbSO4-2e-+2H2O═PbO2+SO42-+4H+,
故答案为:PbSO4-2e-+2H2O═PbO2+SO42-+4H+.
点评 本题考查原电池与电解池工作原理,关键是明确各个电极上发生的反应,注意根据氧化还原反应判断电极,比较基础.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
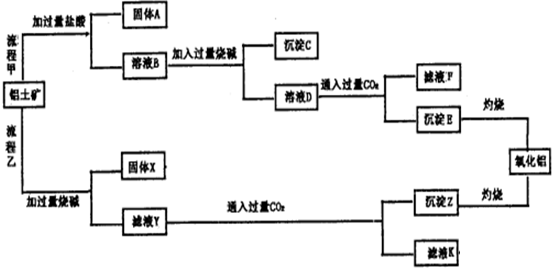
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | Na2SO3固体、浓H2SO4 | SO2 | |
| Ⅳ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
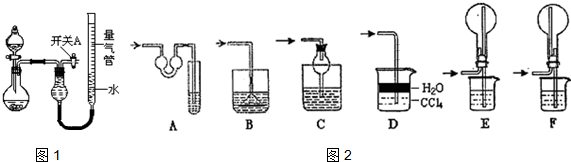
| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
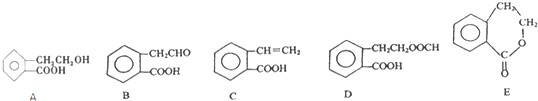
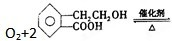 2
2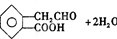
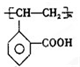
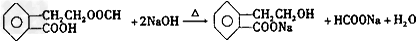 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
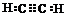 ,A的二氯取代物有1种.
,A的二氯取代物有1种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
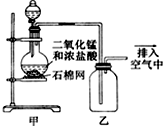
| A. | 该装置图中至少存在两处明显错误 | |
| B. | 烧瓶中的MnO2可换成KClO3或KMnO4 | |
| C. | 在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出 | |
| D. | 在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- | |
| B. | 能使酚酞试液变红的溶液:Na+、K+、HCO3-、S2- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:Na+、I-、SCN-、SO42- | |
| D. | 由水电离出的c(H+)=1.0×10-13 mol•L-1的溶液中:Na+、HCO3-、Cl-、Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com