
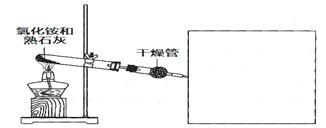
 CaCl2+2NH3↑+2H2O(2分)
CaCl2+2NH3↑+2H2O(2分) (1分,没画棉花不扣分)
(1分,没画棉花不扣分) CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.NH4H是共价化合物 |
| B.NH4H溶于水所形成的溶液显酸性 |
| C.NH4H与水反应时,NH4H是氧化剂 |
| D.NH4H固体投入少量水中,有两种气体生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
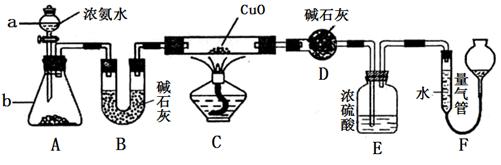
| A.Cl2与饱和食盐水 | B.CO2 与40%的NaOH溶液 |
| C.NH3与饱和食盐水 | D.HCl与水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
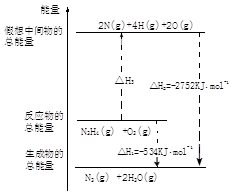
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若管道漏气遇氨就会产生白雾 | B.该反应利用了氨气的还原性 |
| C.该反应属于复分解反应 | D.生成6molNH4Cl有18mol电子转移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稀硝酸能使红色石蕊试纸变蓝 |
| B.硝酸能与Na 2CO3反应,但不能生成CO2 |
| C.硝酸的氧化性很强,能氧化所有金属 |
| D.浓硝酸因分解放出NO2又溶解于硝酸而呈黄色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.Cu Cu(NO3)2 Cu(NO3)2 | B.Cu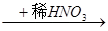 Cu(NO3)2 Cu(NO3)2 |
C.Cu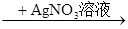 Cu(NO3)2 Cu(NO3)2 | D.Cu  CuO CuO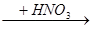 Cu(NO3)2 Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
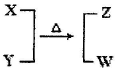
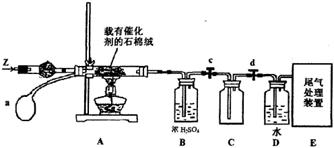
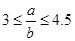 ,则被还原的HNO3的质量为 g。
,则被还原的HNO3的质量为 g。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com