
| c(标准)×V(标准) |
| V(待测) |
| ||
| ||


科目:高中化学 来源: 题型:
| ||
| 温度 | 溶解度/g | ||
| K2CO3 | KOH | KMnO4 | |
| 20℃ | 111 | 112 | 6.38 |
| 60℃ | 127 | 154 | 22.1 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 温度 | 溶解度/g | ||
| K2CO3 | KOH | KMnO4 | |
| 20℃ | 111 | 112 | 6.38 |
| 60℃ | 127 | 154 | 22.1 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省十三校高三3月第一次联考化学试卷(解析版) 题型:实验题
K3[Fe(C2O4)3]·3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应过程如下。请回答下列问题:

(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是??????????????? (填序号)。

(2)在得到的FeSO4溶液中需加入少量的H2 SO4酸化,目的是?????????????????? ,得到K3[Fe(C2O4)3]溶液后,加入乙醇的目的是??????????????????????????? 。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算。
步骤⑤的目的是????????????????????????????????????????????????????????????????? 。
(4)C2O 可被酸性KMnO4溶液氧化为CO2气体,故实验产物中K3[Fe(C2O3)3]·3H2O含量测定可用KMnO4标准溶液滴定。
可被酸性KMnO4溶液氧化为CO2气体,故实验产物中K3[Fe(C2O3)3]·3H2O含量测定可用KMnO4标准溶液滴定。
①写出滴定过程中发生反应的离子方程式???????????????????????????????????????????? 。
②下列滴定操作中使滴定结果偏高的是????????????? (填序号)。
A.滴定管用蒸馏水洗涤后,立即装入标准液
B.锥形瓶在装待测液前未用待测液润洗
C.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
D.读取标准液体积时,滴定前仰视读数,滴定后俯视读数
③取产物10.0 g配成100 mL溶液,从中取出20 mL于锥形瓶中,用浓度为0.1mol·L-l的酸性KMnO4溶液滴定,达到滴定终点时消耗酸性KMnO4溶液24.00mL,则产物中K3 [Fe(C2O4)3]·3H2O的质量分数为???? [已知摩尔质量M{ K3[Fe(C2O4)3]·3H2O)=491 g·mol-l]。
查看答案和解析>>
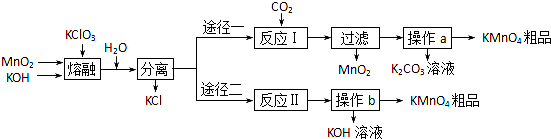
科目:高中化学 来源:2013-2014学年浙江省六市六校联盟高考模拟考试理科综合化学试卷(解析版) 题型:实验题
K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用废铁屑等物质为原料制备,并测定产品的纯度。相关反应的化学方程式为:Fe + H2SO4 =FeSO4 + H2↑???? FeSO4+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4
2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
回答下列问题:
(1)使用废铁屑前,往往将其在1.0mol.L-1Na2CO3溶液中浸泡数分钟,其目的是????????????? 。然后使用?????????????? (填写操作名称)分离并洗涤铁屑。
(2)析出的K3[Fe(C2O4)3]·3H2O晶体可通过如下图所示装置通过减压过滤与母液分离。下列关于减压过滤的操作正确的是??????? 。

A.选择比布氏漏斗内径略小又能将全部小孔? 盖住的滤纸
B.放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤
C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再打开水龙头抽滤
D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸
(3)使用高锰酸钾法(一种氧化还原反应滴定法)可以测定所得产品的纯度。若需配制浓度为0.03000 mol·L-1KMnO4标准溶液240mL,应准确称取?????????????? g KMnO4(保留四位有效数字,已知M KMnO4=158.0g.mol-1)。配制该标准溶液时,所需仪器除电子天平、药匙、烧杯、玻璃棒外,还缺少的玻璃仪器有????????????????????????????????? 。配制过程中,俯视刻度线定容则导致所配溶液浓度?????????????? (填“偏大”、“偏小”或“无影响”)。
(4)某同学称取2.000g产品,经预处理后配制成100mL溶液,移取25.00mL溶液于锥形瓶中,使用0.03000 mol·L-1KMnO4标准溶液滴定,消耗标准溶液10.00mL。
①实际进行滴定时,往往使用酸化的KMnO4标准溶液,写出该滴定反应的离子方程式???????? 。
②判断到达滴定终点的现象是????????????????????????????????????????????????? 。
③该产品的纯度为???????? ﹪(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
名称 | 分子式 | 颜色、状态 | 溶解性/g | 熔点/℃ | 密度/g·cm-3 |
乙二酸 | H2C2O4 | —— | 8.6(20℃) | 189.5 | 1.900 |
二水合乙二酸 | H2C2O4·2H2O | 无色晶体 | —— | 101.5 | 1.650 |
注:表中“——”表示尚未有具体数据。
回答下列问题:
(1)向盛有Na2CO3粉末的试管里加入约3 mL乙二酸溶液,观察到的现象为_____________;说明乙二酸的酸性比碳酸____________。
(2)向盛有5 mL乙二酸饱和溶液的试管中滴入3滴硫酸酸化的0.5%(质量分数)的KMnO4溶液,振荡,观察到现象为_______________________________________________________;说明乙二酸有______________________。
(3)向A试管中加入3 mL乙醇,然后,边振荡试管边加入2 mL 浓硫酸和2 mL乙二酸,按图甲连接好装置,加热3—5 min,在B试管中有油状、香味液体产生。该现象说明发生了______________(填有机反应类型)反应。在B试管中加入饱和Na2CO3溶液的目的是_______________________________________________________________。
导管在液面上的原因是________________________________________________。

(4)图乙是中学化学实验常用的装置,用此装置可制备的气体有___________(填标号)。
A.O2 B.H2 C.Cl2 D.NH3 E.CH2====CH2 F.CH![]() CH
CH
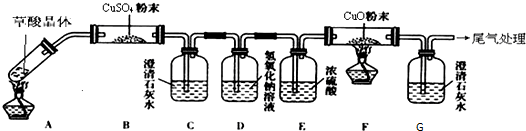
图乙试管口略低于试管底部的原因是_________________________________________。已知草酸分解的化学方程式为H2C2O4![]() H2O+CO2↑+CO↑。用图丙加热草酸晶体,验证草酸受热分解及其产物,图丙是中学化学教材中给出的实验装置图,但有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,指出图丙不合理的原因。
H2O+CO2↑+CO↑。用图丙加热草酸晶体,验证草酸受热分解及其产物,图丙是中学化学教材中给出的实验装置图,但有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,指出图丙不合理的原因。
答:______________________________________________________________。
该装置也不符合绿色化学的要求,因为________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com