分析:A.氮气分子中存在氮氮三键,每个N最外层达到8电子稳定结构,该电子式中漏掉了氮原子的孤电子对;
B.二氧化碳分子中的氧原子最外层电子超过了8个;
C.水为共价化合物,分子中存在两个氧氢键,氧原子最外层达到8电子稳定结构;
D.氯化铵为离子化合物,铵根离子的各原子的最外层电子数没有标出.
解答:解:A.氮气分子中,氮原子最外层已经达到8电子稳定结构,氮气正确的电子式为:
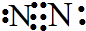
,故A错误;
B.二氧化碳为共价化合物,分子中存在两个碳氧双键,氧原子最外层为8个电子,正确的电子式为:
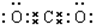
,故B错误;
C.水中存在两个氧氢键,氧原子最外层8个电子,水分子的电子式为:

,故C正确;
D.氯化铵为离子化合物,阳离子铵根离子的原子必须标出最外层电子数,正确的电子式为:
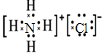
,故D错误;
故选C.
点评:本题考查电子式的书写,难度中等,注意未成键的孤对电子对容易忽略,要求掌握电子式的书写方法,如:简单阳离子的电子式为其离子符合,复杂的阳离子电子式除应标出共用电子对、非共用电子对等外,还应加中括号,并在括号的右上方标出离子所带的电荷.


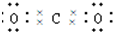

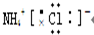
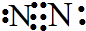 ,故A错误;
,故A错误;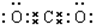 ,故B错误;
,故B错误; ,故C正确;
,故C正确;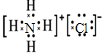 ,故D错误;
,故D错误;

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案