
【题目】CO2是主要的温室气体,也是一种工业原料。回收利用CO2有利于缓解温室效应带来的环境问题。
(1)我国科学家通过采用一种新型复合催化剂,成功实现了CO2直接加氢制取高辛烷值汽油。
已知:2H2 (g)+O2 (g) =2H2O(l) ΔH = -571.6 kJ/mol
2C8H18(l)+25O2(g) =16CO2(g)+18H2O(l) ΔH = -11036 kJ/mol
25℃、101kPa条件下,CO2与H2反应生成辛烷(以C8H18表示)和液态水的热化学方程式是_________。
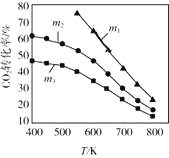
(2)CO2催化加氢合成乙醇的反应原理是:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol图是起始投料不同时,CO2的平衡转化率随温度的变化关系,m为起始时的投料比,即m=
C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol图是起始投料不同时,CO2的平衡转化率随温度的变化关系,m为起始时的投料比,即m=![]() 。m1、m2、m3投料比从大到小的顺序为_________,理由是_________。
。m1、m2、m3投料比从大到小的顺序为_________,理由是_________。
(3)在Cu/ZnO催化剂存在下,将CO2与H2混合可合成甲醇,同时发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ/mol
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ/mol
反应Ⅱ CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
控制一定的CO2和H2初始投料比,在相同压强下,经过相同反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
实验序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
实验1 | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
实验2 | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
实验3 | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
实验4 | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
①对比实验1和实验3可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因_______________;
②对比实验1和实验 2可发现:在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因____________。
③有利于提高CO2转化为CH3OH平衡转化率的措施有_______。
a.使用Cu/ZnO纳米棒做催化剂
b.使用Cu/ZnO纳米片做催化剂
c.降低反应温度
d.投料比不变,增加反应物的浓度
e.增大![]() 的初始投料比
的初始投料比
(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2,电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是_____________。
②工业上生产1.4×104 kg 的LDPE,理论上需要标准状况下______L 的CO2。
【答案】8CO2(g)+25H2(g) =C8H18(l)+16H2O(l) ΔH= -1627kJ/mol m1 >m2>m3 温度相同时,c(H2)增大, CO2平衡转化率增大,平衡向正反应方向移动。 反应Ⅰ是放热反应,升高温度,平衡向逆反应方向进行,因此甲醇的产率减小,甲醇的选择性降低。 Cu/ZnO纳米片对反应I的催化作用更好,测定时间内得到的甲醇较多,甲醇选择性提高。 cd 2nCO2 +12nH+ +12ne-=![]() +4n H2O 2.24×107
+4n H2O 2.24×107
【解析】
(1)利用盖斯定律,将两个热化学方程式中O2消去,整理,就可得到相应的热化学方程式;
(2) 一定温度下二氧化碳转化率随m(为起始时的投料比)增大而增大,使一种反应物浓度增大一种会提高另一种物质的平衡转化率;
(3)①反应Ⅰ是放热反应,根据温度对化学平衡的影响分析;
②使用Cu/ZnO纳米片催化剂使反应I速率增加,该时间内得到的甲醇较多,甲醇选择性提高;
③有利于提高CO2转化为CH3OH平衡转化率,需要使平衡向正反应方向移动,结合平衡移动原理分析。
(4)电解过程中阴极上CO2发生还原反应生成![]() :结合碳的化合价的变化,分析得到的电子数目,根据电荷守恒可得该电极反应式,并结合电极反应式及物质的量公式计算。
:结合碳的化合价的变化,分析得到的电子数目,根据电荷守恒可得该电极反应式,并结合电极反应式及物质的量公式计算。
(1) ①2H2 (g)+O2 (g) =2H2O(l) ΔH = -571.6 kJ/mol ;②2C8H18(l)+25O2(g) =16CO2(g)+18H2O(l) ΔH = -11036 kJ/mol,(①×25-②)÷2,整理可得:8CO2(g)+25H2(g) =C8H18(l)+16H2O(l) ΔH= -1627kJ/mol;
(2) CO2催化加氢合成乙醇的反应原理是:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol,根据方程式可知:CO2、H2都是反应物,根据平衡移动原理可知,在温度不变时,c(H2)增大,平衡正向移动,CO2转化率增大,即一定温度下二氧化碳转化率随m(为起始时的投料比)增大而增大,根据图示可知转化率:m1>m2>m3,所以m1、m2、m3投料比从大到小的顺序为:m1>m2>m3;
C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol,根据方程式可知:CO2、H2都是反应物,根据平衡移动原理可知,在温度不变时,c(H2)增大,平衡正向移动,CO2转化率增大,即一定温度下二氧化碳转化率随m(为起始时的投料比)增大而增大,根据图示可知转化率:m1>m2>m3,所以m1、m2、m3投料比从大到小的顺序为:m1>m2>m3;
(3) ①同样催化剂条件下,温度升高,CO2转化率升高,而甲醇的选择性却降低的原因是反应Ⅰ为生成甲醇的反应,该反应是放热反应,升高温度,平衡逆向进行,因此甲醇的产率减小,甲醇的选择性降低;
②在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低,而甲醇的选择性却提高的可能原因是在该时间内,使用Cu/ZnO纳米片催化剂使反应I速率增加,因此测得该时间内得到的甲醇较多,甲醇选择性提高;
③a.使用Cu/ZnO纳米棒做催化剂,对化学平衡无影响,无法提高CO2转化为CH3OH平衡转化率,a错误;
b.使用Cu/ZnO纳米片做催化剂,催化剂不影响化学平衡移动,无法提高CO2转化为CH3OH平衡转化率,b错误;
c.该反应为放热反应,降低反应温度,平衡向正反应方向移动,可提高CO2转化为CH3OH平衡转化率,c正确;
d.投料比不变,增加反应物氢气的浓度,可提高CO2转化为CH3OH平衡转化率,d正确;
e.增大CO2和H2的初始投料比,二氧化碳浓度增大,则CO2转化率降低,e错误;
故合理选项为cd。
(4)电解过程中阴极上CO2发生还原反应生成![]() :由C原子守恒可知关系式为2nCO2→
:由C原子守恒可知关系式为2nCO2→![]() ,碳的化合价从+4变为-2,每个C原子得到6个电子,则2nCO2总共得到12n个电子,结合电荷守恒可得该电极反应式为:2nCO2+12e-+12nH+=
,碳的化合价从+4变为-2,每个C原子得到6个电子,则2nCO2总共得到12n个电子,结合电荷守恒可得该电极反应式为:2nCO2+12e-+12nH+=![]() +4nH2O,需要二氧化碳的物质的量为n(CO2)=
+4nH2O,需要二氧化碳的物质的量为n(CO2)=![]() =1×106mol,则在标准状况下CO2的体积为V(CO2)=1×106mol×22.4L/mol=2.24×107L。
=1×106mol,则在标准状况下CO2的体积为V(CO2)=1×106mol×22.4L/mol=2.24×107L。


科目:高中化学 来源: 题型:
【题目】格氏试剂RMgX由Mg和卤代烃RX在干燥下的乙醚中反应制得,广泛用于复杂有机物的合。下图是著名香料(![]() )的合成路线。
)的合成路线。

(1)写出反应Ⅰ的反应条件____,反应Ⅱ的反应类型为____,化合物C的名称是____。
(2)写出下列物质的结构简式: E____ , F____。
(3)写出苯 → C的化学方程式:____
(4)A有多种同分异构体,其中苯环上有两种化学环境氢的同分异构体(含-MgBr结构)有____种。
(5)设计原料(![]() )合成产物(
)合成产物( )的合成路线:____
)的合成路线:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )
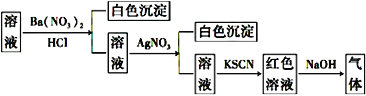
A. 原溶液中一定含有SO42-B. 原溶液中一定含有NH4+
C. 原溶液中一定含有Cl-D. 原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Na2CO3俗称纯碱,写出水解常数的表达式为Kh=___________。已知25℃时,Kh=2×10-4mol/L,则当溶液中c(HCO3-)∶c(CO32-) = 2∶1时,试求溶液的pH=____。
(2)氢离子浓度为0.1 mol·L-1的盐酸、硫酸、醋酸三种溶液,
①三种溶液的浓度依次为a mol·L-1,b mol·L-1,c mol·L-1,其大小顺序为____________。
②等体积的三种酸分别与NaOH溶液中和生成正盐时,消耗NaOH的物质的量依次是n1、n2、n3,其大小关系_______________。
(3)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是___________________。
(4)在纯碱溶液中滴入酚酞,溶液变红色,若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是_____________;原因是______________。(结合相关离子方程式和文字加以解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。当电池工作时,有关说法正确的是( )

A.铝罐将逐渐被腐蚀
B.碳粒和碳棒上发生的反应为O2+2H2O-4e-=4OH-
C.碳棒应与玩具电机的负极相连
D.该电池工作一段时间后碳棒和碳粒的质量会减轻
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一体积可变的容器中进行。下列条件的改变对其化学反应速率几乎没有影响的是:①增加C的用量;②将容器体积缩小一半;③保持容器体积不变,充入氮气使容器内压强增大;④保持压强不变,充入氮气使容器的体积变大
CO(g)+H2(g)在一体积可变的容器中进行。下列条件的改变对其化学反应速率几乎没有影响的是:①增加C的用量;②将容器体积缩小一半;③保持容器体积不变,充入氮气使容器内压强增大;④保持压强不变,充入氮气使容器的体积变大
A. ②④ B. ①③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)具有良好的热稳定性、耐热性、电绝缘性,是目前用量最大的热稳定剂,工业上利用铅废渣(主要含PbSO4、 PbCl2、 SiO2)制取三盐基硫酸铅及PbO2工艺流程如下:

已知:①“浸出”过程发生的反应:PbSO4(s)+2Cl-(aq)![]() PbCl2+SO42-(aq)和
PbCl2+SO42-(aq)和
PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0,
PbCl42-(aq) △H>0,
②Ksp(PbCl2)=1.7×10-5 Ksp(PbSO4)=2.5×10-8
回答下列问题:
(1)铅渣“浸出”后,“浸出渣”的主要成分是CaSO4和___________。
(2)“操作1”通过多步操作得到PbCl2,分别为___________、___________、过滤、洗涤。
(3)“转化”后得到PbSO4,当c(Cl-)=0.100mol/L时,c(SO42-)=___________(结果保留一位小数);“转化”时需要升高体系温度,其原因是_________________________________。
(4)写出合成三盐基硫酸铅的化学方程式_________________________________。
(5)氨水络合后铅的存在形态是[ Pb(OH)SO4]-,写出“氧化”发生的离子反应方程式__________________________________________________________________。
(6)一种新型的铅锂电池的充放电示意图如下,写出放电时的正极反应式___________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com