
分析 在水溶液里或熔融状态下能导电的化合物是电解质;
在水溶液里或熔融状态下都不导电的化合物是非电解质;
含有自由移动的电子或自由移动的阴阳离子的物质就能导电,据此分析.
解答 解:①NaCl溶液中有自由移动的离子,故能导电,但是混合物,故不是电解质也不是非电解质;
②干冰不能导电,且在水溶液中和熔融状态下均不能导电,故为非电解质;
③冰醋酸(纯净的醋酸)无自由移动的离子,故不能导电;但在水溶液中能导电,故为电解质;
④铜能导电,但是单质,故不是电解质也不是非电解质;
⑤BaSO4固体无自由移动的离子,故不能导电;但在熔融状态下能导电,故为电解质;
⑥蔗糖无自由移动的离子和电子,故不能导电;且在水溶液中和熔融状态下均不能导电,故为非电解质;
⑦酒精无自由移动的离子和电子,故不能导电;且在水溶液中和熔融状态下均不能导电,故为非电解质;
⑧熔融的KNO3有自由移动的离子,故能导电,是电解质.
故答案为:③⑤⑧;②⑥⑦;①④⑧.
点评 本题考查了物质能否导电以及电解质、非电解质的判断,难度不大,应注意的是电解质不一定能导电,能导电的不一定是电解质.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
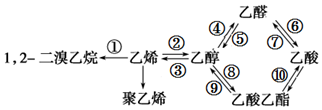
| A. | 反应①是加成反应,产物的结构简式 CH3CHBr2 | |
| B. | 反应②④⑥是氧化反应,其中④是去氢氧化 | |
| C. | 反应⑦⑧⑨⑩是取代反应,其中⑧是酯化反应 | |
| D. | ③是消去反应,反应的副产物中有SO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.45mol/L | B. | 0.5mol/L | C. | 0.6mol/L | D. | 0.55mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸工业中,增大O2的浓度有利于提高SO2的转化率 | |
| B. | 开启啤酒瓶后,瓶中立刻泛起大量泡 | |
| C. | 对2HI(g)?H2(g)+I2(g)平衡体系增加压强使颜色变深 | |
| D. | 滴有酚酞的氨水溶液,适当加热溶液(氨气不挥发)后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
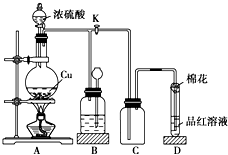 某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答:
某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
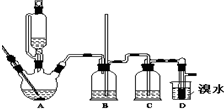 实验室制备1,2二溴乙烷的反应原理如下:
实验室制备1,2二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com