
| A. | HF、HCl、HBr、HI | B. | KMnO4、CuCl2、FeCl3,NaCl | ||
| C. | KNO3、KI、AgNO3、Na2CO3 | D. | 溴水、NaCl、NaBr、KI |
分析 A.均为无色,且相互之间不反应;
B.KMnO4为紫色,CuCl2为蓝色,FeCl3为黄色,NaCl为无色;
C.AgNO3分别与KI、Na2CO3反应生成沉淀,且AgI为黄色沉淀;
D.溴水与NaCl、NaBr均不反应.
解答 解:A.均为无色,且相互之间不反应,不用任何其它试剂不能鉴别,故A不选;
B.KMnO4为紫色,CuCl2为蓝色,FeCl3为黄色,NaCl为无色,则利用观察颜色可鉴别,故B选;
C.AgNO3分别与KI、Na2CO3反应生成沉淀,且AgI为黄色沉淀,则可利用反应现象依次鉴别,故C选;
D.溴水与NaCl、NaBr均不反应,则不用任何其它试剂不能鉴别NaCl、NaBr,故D不选;
故选BC.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质(颜色、试剂之间的反应)为解答本题的关键,注意现象相同时不能鉴别,侧重物质之间的反应的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16 | B. | 14 | C. | 12 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y均能燃烧,都有大量浓烟产生 | |
| B. | X既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,还能发生加聚反应 | |
| C. | Y中含有碳碳双键 | |
| D. | Y的二氯代物有三种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水含有NA个水分子 | |
| B. | 氧气和臭氧的混合物32 g中含有NA个氧原子 | |
| C. | 7.8g Na2O2与水反应时转移0.1NA个电子 | |
| D. | 1.12L氯气中含有NA个氯原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
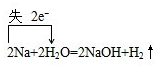 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、盐酸 | B. | NaOH溶液、CO2 | ||
| C. | NaHCO3溶液、石灰水 | D. | Na2O2、稀硫酸 |
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:推断题
[化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________,D原子的杂化类型为_______________。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________(填“大于”、“小于”、或“等于”)N的沸点,原因是_______________。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________。写出相应的化学反应方程式:____________________。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________,加入乙醇的作用是________________。
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______g.cm-3

查看答案和解析>>
科目:高中化学 来源:2017届山西大学附中高三上10月模块诊断化学试卷(解析版) 题型:填空题
氧族元素是指位于元素周期表第16列的元素,包括氧、硫、硒(Se)、碲(Te)、钋(Po)五种元素。请回答下列问题:
(1)与氧同周期的相邻的元素中,第一电离能由大到小的顺序为________________。(填元素符号)
(2)气态SO3分子的空间构型为______________;与其互为等电子体的阴离子为___________(举一例)。
(3)将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图,此固态SO3中S原子的杂化轨道类型是_____________。
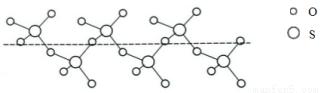
(4)元素X与硒同周期,X元素原子核外未成对电子数最多,X为_________(填元素符号);X的基态原子的电子排布式为___________________。
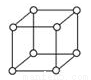
(5)单质钋是由___________键形成的晶体;有资料表明,只有钋的晶体中的原子具有如图所示的堆积方式,若已知Po的摩尔质量为M g·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,则钋晶体的密度的表达式为____________g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com