
 2SO3(g) ��H����196.6 kJ��mol��1��Ӧ���̵������仯ʾ��ͼ��
2SO3(g) ��H����196.6 kJ��mol��1��Ӧ���̵������仯ʾ��ͼ��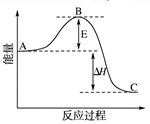
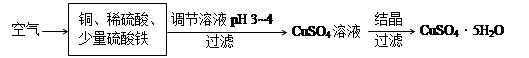
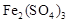 ������ã�ʹ��Ӧ������������ɣ�
������ã�ʹ��Ӧ������������ɣ�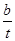 (1��) ��2�� ��4Fe2����O2��4H����4Fe3����2H2O (2��)
(1��) ��2�� ��4Fe2����O2��4H����4Fe3����2H2O (2��)  TiO2+4HCl(2��)
TiO2+4HCl(2��)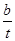 mol/(L��min)��
mol/(L��min)�� TiO2+4HCl��
TiO2+4HCl��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g) ��H
CH3OH(g) ��H| ��ѧ�� | C��C | C��H | H��H | C��O | C��O | H��O |
| ����/kJ��mol��1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| ��Ӧʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 |
| ѹǿ/MPa | 12��6 | 10��8 | 9��5 | 8��7 | 8��4 | 8��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

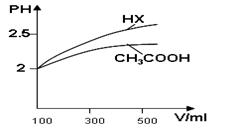
 CO2(g)+H2(g)���÷�Ӧ�ġ�H________0��ѡ�����������������������������900Kʱ���÷�Ӧƽ�ⳣ���Ķ���ֵ��lgK��=_____________.
CO2(g)+H2(g)���÷�Ӧ�ġ�H________0��ѡ�����������������������������900Kʱ���÷�Ӧƽ�ⳣ���Ķ���ֵ��lgK��=_____________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 N������941kJ��������1molN4����ת��Ϊ2molN2ʱҪ�ų�______________ kJ������
N������941kJ��������1molN4����ת��Ϊ2molN2ʱҪ�ų�______________ kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ��ѧ�� | �Ͽ�1mol��ѧ�������������kJ�� |
| H��H | 436 |
| O��H | 463 |
| O=O | 498 |
| ʵ���� | ��Ӧ�� | ���� | |
| a | 50 mL 5% H2O2��Һ | | 1 mL 0.1 mol��L-1 FeCl3��Һ |
| b | 50 mL 5% H2O2��Һ | ����Ũ���� | 1 mL 0.1 mol��L-1 FeCl3��Һ |
| c | 50 mL 5% H2O2��Һ | ����ŨNaOH��Һ | 1 mL 0.1 mol��L-1 FeCl3��Һ |
| d | 50 mL 5% H2O2��Һ | | MnO2 |
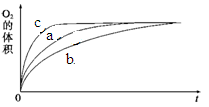
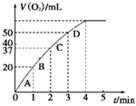
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
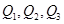 ���߹�ϵ��ȷ����
���߹�ϵ��ȷ����| A��Q1��Q2��Q3 | B��Q1��Q3��Q2 | C��Q3��Q2��Q1 | D��Q2��Q1��Q3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 W (s) + 3H2O (g)
W (s) + 3H2O (g) | �¶� | 25�� ~ 550�� ~ 600�� ~ 700�� |
| ��Ҫ�ɷ� | WO3 W2O5 WO2 W |
 W (s) + 2H2O (g)����H �� +66.0 kJ��mol��1
W (s) + 2H2O (g)����H �� +66.0 kJ��mol��1  W (s) + 2H2O (g)����H �� ��137.9 kJ��mol��1
W (s) + 2H2O (g)����H �� ��137.9 kJ��mol��1  WO2 (g) �Ħ�H �� ______________________��
WO2 (g) �Ħ�H �� ______________________�� WI4 (g)������˵����ȷ����____________��
WI4 (g)������˵����ȷ����____________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| | Fe | H2O��g�� | Fe3O4 | H2 |
| ��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ��/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| | Fe | H2O��g�� | Fe3O4 | H2 |
| ��ʼ/mol | 3.0 | 4.0 | 0 | 0 |
| ƽ��/mol | m | n | p | q |
| | Fe | H2O��g�� | Fe3O4 | H2 |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1 | 4 |
| C/mol | m | n | p | q |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com