
(1)若发烟硫酸用H2SO4·xSO3表示,其x=________。
(2)若只用水吸收SO3(假设吸收完全)生产含SO3 20%的发烟硫酸,则
(3)若只用98%的浓硫酸来完全吸收SO3生产含SO3 20%的发烟硫酸,则
解析:首先,推断出“发烟硫酸”和“98%的浓硫酸”这两种混合物的“化学式”,它们分别为“H2SO4·0.306 SO![]() H2O或9H2SO4·H2O”;然后,建立含有混合物的“化学式”在内的“化学方程式”并进行计算:
H2O或9H2SO4·H2O”;然后,建立含有混合物的“化学式”在内的“化学方程式”并进行计算:
当用H2O吸收时:
H2O+1.306 SO3=H2SO4·0.306 SO3
18 1.306
m1 ![]()
得m1=2.76×
当用98%的浓H2SO4吸收时:
9H2SO4·H2O+4.06SO3=10(H2SO4·0.306 SO3)
9×98+18 4.06
m2 ![]()
m2=4.43×
答案:(1)0.306 (2)27.6 (3)4.43×105 g


科目:高中化学 来源: 题型:
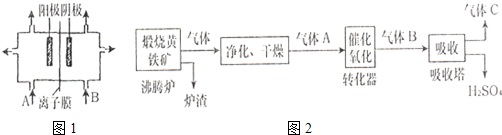
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
请计算(计算结果保留三位有效数字):
(1)若发烟硫酸用H2SO4·xSO3表示,则x的值是_______;
(2)若只用水吸收SO3(假设吸收完全)生产该发烟硫酸,求出448 m3(已折算成标准状况)“出口气体”所需要用水的质量;
(3)若只用98%的浓H2SO4来完全吸收SO3生产发烟硫酸,计算出448 m3(已折算成标准状况)“出口气体”所需要用98%的浓H2SO4的质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com