
【题目】下列气体溶于水,所得溶液呈碱性的是
A.NH3B.NO2C.SO2D.SO3
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】(1)Na2CO3俗称纯碱,写出水解常数的表达式为Kh=___________。已知25℃时,Kh=2×10-4mol/L,则当溶液中c(HCO3-)∶c(CO32-) = 2∶1时,试求溶液的pH=____。
(2)氢离子浓度为0.1 mol·L-1的盐酸、硫酸、醋酸三种溶液,
①三种溶液的浓度依次为a mol·L-1,b mol·L-1,c mol·L-1,其大小顺序为____________。
②等体积的三种酸分别与NaOH溶液中和生成正盐时,消耗NaOH的物质的量依次是n1、n2、n3,其大小关系_______________。
(3)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是___________________。
(4)在纯碱溶液中滴入酚酞,溶液变红色,若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是_____________;原因是______________。(结合相关离子方程式和文字加以解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)该反应的离子方程式为_______。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)已知50 ℃时c(MnO4—)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO4—)~t的变化曲线示意图_____。

(4)在25 ℃、101 kPa时,1 g CH4完全燃烧生成液态水时放出的热量是55.0kJ,则表示甲烷燃烧热的热化学方程式是____________________________。
(5)已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示。该反应是一个______________(填“熵增”或“熵减”)的反应。下列有关该反应的叙述中正确的是______。

A.该反应是放热反应
B.该反应的ΔH=-(E1-E2) kJ· mol-1
C.该反应中反应物的键能总和大于生成物的键能总和
D.由2 mol A(g)和4 mol B(g)形成4 mol A—B键吸收E2 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的电化学脱硫是借助煤在电解槽阳极发生的电化学氧化反应,将煤中黄铁矿(FeS2)或有机硫化物氧化成可溶于水的含硫化合物而达到净煤目的,下图是一种脱硫机理,则下列说法正确的是
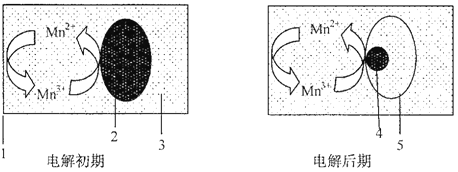
l—电极a 2—黄铁矿 3—MnSO4、H2SO4混合溶液 4—未反应黄铁矿 5一电解产品
A. Mn3+充当了电解脱硫过程的催化剂
B. 电极a应与电源负极相连
C. 脱硫过程中存在的离子反应为:8H2O+FeS2+15Mn3+=Fe3++16H++2SO42-+15Mn2+
D. 阴极发生的反应:2H2O+2e-=4H++O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)具有良好的热稳定性、耐热性、电绝缘性,是目前用量最大的热稳定剂,工业上利用铅废渣(主要含PbSO4、 PbCl2、 SiO2)制取三盐基硫酸铅及PbO2工艺流程如下:

已知:①“浸出”过程发生的反应:PbSO4(s)+2Cl-(aq)![]() PbCl2+SO42-(aq)和
PbCl2+SO42-(aq)和
PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0,
PbCl42-(aq) △H>0,
②Ksp(PbCl2)=1.7×10-5 Ksp(PbSO4)=2.5×10-8
回答下列问题:
(1)铅渣“浸出”后,“浸出渣”的主要成分是CaSO4和___________。
(2)“操作1”通过多步操作得到PbCl2,分别为___________、___________、过滤、洗涤。
(3)“转化”后得到PbSO4,当c(Cl-)=0.100mol/L时,c(SO42-)=___________(结果保留一位小数);“转化”时需要升高体系温度,其原因是_________________________________。
(4)写出合成三盐基硫酸铅的化学方程式_________________________________。
(5)氨水络合后铅的存在形态是[ Pb(OH)SO4]-,写出“氧化”发生的离子反应方程式__________________________________________________________________。
(6)一种新型的铅锂电池的充放电示意图如下,写出放电时的正极反应式___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA代表阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,18g的D2O含有的中子数、电子数均为10NA
B. 1.0 mol/L的FeCl3溶液中Fe3+的个数小于NA
C. 标准状况下,2.24 L甲醛中碳氢键的数目为0.2NA
D. 密闭容器中,加入2molHI,发生反应:2HI(g) ![]() H2(g)+I2(g),达到平衡后气体分子总数小于2NA
H2(g)+I2(g),达到平衡后气体分子总数小于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液溶质的质量分数为10%,下面说法正确的是( )
①在100份质量溶液中含有10份质量溶质;②在110份质量溶液中含有10份质量溶质;
③在100份质量溶剂中含有10份质量溶质;④在90份质量溶剂中溶有10份质量溶质。
A. ①② B. ③④ C. ②③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4、NiCl2是制取高纯镍和电镀行业的重要原料,回答下列问题:
(1)碱性条件下利用肼(N2H2)还原NiCl2溶液可生成高纯Ni纳米粒子和某气体单质,写出反应的离子方程式_________________________________。温度对反应时间和Ni粒径的影响如图所示,温度为___________(选填字母)℃时,很难形成纳米级别的Ni(已知纳米级别的Ni与胶体分散质的大小一致)。
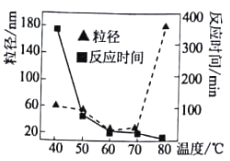
A.43 B.50 C.64 D.79
(2)利用某含镍废料(主要成分为Ni,还含有铝、铁的氧化物)可制备硫酸镍晶体(NiSO4·7H2O),其流程如图所示:

已知:Ksp[Ni(OH)2]=2.0×10-15 K sp[Fe(OH)2]=8.0×10-16
K sp[Fe(OH)3]=4.0×10-38
①写出“氧化”步骤中发生反应的化学方程式_________________________________,步骤需要控制温度40℃左右,其目的是_________________________________。
②已知“酸浸”所得滤液中c(Ni2+)=1mol/L,c(Fe2+)=0.1mol/L,试通过计算证明“氧化”步骤的必要性__________________________________________________________________(离子浓度小于1×10-5mol/L时可认为沉淀完全,要有计算过程和合理的文字叙述)。
③“系列操作”包括__________、冷却结晶、过滤、乙醇洗涤、干燥等操作,其中利用乙醇洗涤硫酸镍晶体的优点是____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com