
| X | |||
| Y | Z | W |
| A. | Z的最高价氧化物的水化物是强酸 | |
| B. | Y的最高价氧化物能溶于烧碱溶液 | |
| C. | X与W形成的化合物中含有离子键 | |
| D. | Z、W分别形成的简单离子中,前者的半径较大 |
分析 短周期元素Y的最外层电子数是最内层电子数的2倍,则由位置可知,Y位于第三周期,3个电子层的电子分别为2、8、4,即Y为Si,Z单质可在空气中燃烧,结合位置可知,X为C,Z为S,W为Cl,然后结合元素周期律及元素化合物知识来解答.
解答 解:短周期元素Y的最外层电子数是最内层电子数的2倍,则由位置可知,Y位于第三周期,3个电子层的电子分别为2、8、4,即Y为Si,Z单质可在空气中燃烧,结合位置可知,X为C,Z为S,W为Cl,
A.Z的最高价氧化物的水化物硫酸是强酸,故A正确;
B.Y的最高价氧化物为二氧化硅,能溶于烧碱溶液,反应生成硅酸钠和水,故B正确;
C.X与W形成的化合物为CCl4,含有C-Cl共价键,故C错误;
D.Z、W分别形成的简单离子,具有相同电子层结构,原子序数大的离子半径小,则前者的半径较大,故D正确;
故选C.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意Y为元素推断的突破口,题目难度不大.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 | |
| B. | Y元素最高价氧化物对应的水化物化学式为H2YO4 | |
| C. | 原子半径由大到小的顺序为Z>Y>W | |
| D. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向AgCl悬浊液中加入NaI溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| C | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| D | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 | |
| B. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾 | |
| D. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,相同浓度的盐酸与氨水的混合溶液的pH=7,消耗盐酸的体积大 | |
| B. | 将pH=5的醋酸溶液稀释1000倍,溶液的pH=8 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
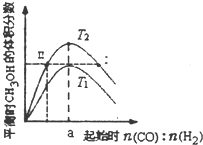 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )| A. | 由图象可推知,反应温度T2>T1 | |
| B. | 同一温度,增大压强,平衡右移,平衡常数K增大 | |
| C. | 同一温度,当a=0.5时,CO转化率最高 | |
| D. | 对于状态I和II,若再向体系中充入He,重新达到平衡后,二者的平衡体系中CH3OH的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝熔点很高,可用于制造耐火坩埚 | |
| B. | 浓硫酸具有脱水性,可用于干燥氢气 | |
| C. | 氢氧化铝能与氢氧化钠反应,可用于治疗胃酸过多 | |
| D. | 二氧化硅能与氢氟酸反应,可用于制光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验装置 | 电解质溶液 | 实验现象 | |
 | 5mol/L NaCl溶液 | a极附近 | b极附近 |
| 开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
| ①氯化亚铜(CuCl)为白色粉末,微溶于水; ②氢氧化亚铜(CuOH)为黄色不溶于水的固体,易脱水分解为红色的Cu2O; ③Cu+水溶液中不稳定,酸性条件下易歧化为Cu2+和Cu; ④氢氧化铜可以溶于浓NaOH得到蓝色溶液. |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
奥运会篮球比赛用球男女有别。男子篮球比赛用7#球,内部空间体积大约是7.35L,比赛时内部压强约为170kPa。己知,在25℃,100kPa时,气体摩尔体积约为24.5L/mol。假设比赛场馆温度为25℃,下列说法中正确的是
A.比赛时,篮球内一般充填氮气
B.比赛时,篮球内约有空气0.3mol
C.比赛时,篮球内约有空气14.8g
D.当25℃,170kPa时,Vm>24.5L/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com