
| ���� | HCOOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� | 1.77��l0�C5 | 4.9��l0�C10 | Ki1=4.3��l0�C7 Ki2=5.6��l0�C11 |


 С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д� ��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ʹ��Һ��pH���� |
| B������ʹ��Һ��c(H+)��c(CH3COO-)���� |
C������ʹ��Һ�� ��ֵ���� ��ֵ���� |
| D����Һ��c(H+)��c(OH-)���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���� | HF | H3PO4 |
| ����ƽ �ⳣ�� | K= 3.6��10��4 | K1=" " 7.5��10��3 K2=" " 6.2��10��8 K3=" " 2.2��10��13 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.1mol/L�İ�ˮ��ʹ��̪��Һ��� |
| B��0.1mol/L���Ȼ����Һ��pHԼΪ5 |
| C������ͬ�����£���ˮ��Һ�ĵ����Ա�ǿ����Һ�� |
| D����������ֽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Ӧ�����У������ձ��в�������������һֱ��� |
| B����Ӧ�����������ձ��в������������ʵ������ |
| C����Ӧ���������ձ�����þ��ʣ�� |
| D����Ӧ�������ձ�����Һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���� | CH3COOH | HCN | H2CO3 |
| K | 1.8��10��5 | 4.9��10��10 | K1=4.3��10��7 K2=5.6��10��11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
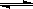 H+��OH������H��0��������������ȷ����
H+��OH������H��0��������������ȷ����| A����ˮ���ȣ�pH��С |
| B�������£���ˮ�м�����������KOH��Kw���� |
| C����ˮ�е���ϡ���ᣬc(H+)���� |
| D����ˮ�м�����������NaClO��ƽ�������ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ˮ�����c(H��)����=��=��=�� |
| B�����ڡ�����Һ��Ϻ�pH=7����������Һ���������=�� |
| C��������Ģ١��ڡ�����Һ�ֱ����������۷�Ӧ������H2����������� |
| D������Һ�м���100mLˮ����Һ��pH���ۣ��ܣ��٣��� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com