
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。
【答案】
(1)防止FeSO4被氧气氧化;除去铁屑表面的油污
(2)n(CO2)= n(MnCO3)=0.01 mol
n(EDTA)=0.0014mol
10 mL溶液中 n(Mn2+)=0.0014mol
7.390 g该碱式碳酸锰中n(Mn2+)=0.07mol,n[Mn(OH)2]=0.06 mol
m(H2O)=0.9 g,nH2O)=0.05 mol
a∶b∶c= 1∶6∶5
碱式碳酸锰的化学式为MnCO3·6Mn(OH)2·5H2O
【解析】
试题分析:(1)硫酸亚铁易被氧化,需要加入铁粉防止硫酸亚铁被氧化,用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是防止FeSO4被氧气氧化,反应前需将废铁屑用热Na2CO3溶液浸泡是利用碳酸钠溶液的碱性除去铁表面的油污,故答案为:防止FeSO4被氧气氧化;除去铁屑表面的油污;
(2)n(CO2)=n(MnCO3)=0.01 mol n(EDTA)=0.0014mol,10 mL溶液中 n(EDTA)=n(Mn2+)=0.028L×0.0500molL-1=0.0014mol,500mL溶液n(Mn2+)=0.0014mol×![]() =0.07mol ,7.390 g 该碱式碳酸锰中 n(Mn2+)=0.07mol ,n[Mn(OH)2]=0.06 mol,m(H2O)=7.390g-0.01mol × 115 g/mol-0.06 mol× 204 g/mol=0.9 g ,n(H2O)=
=0.07mol ,7.390 g 该碱式碳酸锰中 n(Mn2+)=0.07mol ,n[Mn(OH)2]=0.06 mol,m(H2O)=7.390g-0.01mol × 115 g/mol-0.06 mol× 204 g/mol=0.9 g ,n(H2O)=![]() =0.05 mol,a:b:c=1:6:5 碱式碳酸锰的化学式为MnCO36Mn(OH)25H2O。故答案为:n(CO2)=n(MnCO3)=0.01 mol n(EDTA)=0.0014mol,10 mL溶液中 n(EDTA)=n(Mn2+)=0.028L×0.0500molL-1=0.0014mol,500mL溶液n(Mn2+)=0.0014 mol ×
=0.05 mol,a:b:c=1:6:5 碱式碳酸锰的化学式为MnCO36Mn(OH)25H2O。故答案为:n(CO2)=n(MnCO3)=0.01 mol n(EDTA)=0.0014mol,10 mL溶液中 n(EDTA)=n(Mn2+)=0.028L×0.0500molL-1=0.0014mol,500mL溶液n(Mn2+)=0.0014 mol ×![]() =0.07 mol ,7.390 g 该碱式碳酸锰中 n(Mn2+)=0.07mol ,n[Mn(OH)2]=0.06 mol,m(H2O) =7.390g-0.01mol ×115 g/mol-0.06 mol ×204 g/mol=0.9 g ,n(H2O)=
=0.07 mol ,7.390 g 该碱式碳酸锰中 n(Mn2+)=0.07mol ,n[Mn(OH)2]=0.06 mol,m(H2O) =7.390g-0.01mol ×115 g/mol-0.06 mol ×204 g/mol=0.9 g ,n(H2O)=![]() =0.05 mol,a:b:c=1:6:5 碱式碳酸锰的化学式为MnCO36Mn(OH)25H2O。
=0.05 mol,a:b:c=1:6:5 碱式碳酸锰的化学式为MnCO36Mn(OH)25H2O。


科目:高中化学 来源: 题型:
【题目】硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)===BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
BaS(s)===Ba(s)+S(s) ΔH=+460 kJ·mol-1
已知:2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
则:Ba(s)+S(s)+2O2(g)===BaSO4(s) ΔH=________。
Ⅱ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法
反应原理:恒温恒容时2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。
S2(g)+2CO2(g)。
反应进行到不同时间测得各物质的浓度部分图像如图:

①0~20 min反应速率表示为v(SO2)=________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③40 min时,平衡常数K=________。
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是________(填序号)。
a.c(Na+)+c(H+)>c(SO![]() )+c(HSO
)+c(HSO![]() )+c(OH-)
)+c(OH-)
b.水电离出c(H+)=1×10-8 mol/L
c.c(Na+)>c(HSO![]() )>c(H+)>c(SO
)>c(H+)>c(SO![]() )
)
(3)电化学处理法

①如图所示,Pt(Ⅰ)电极的反应式为__________________;
②当电路中转移0.02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加________mol离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
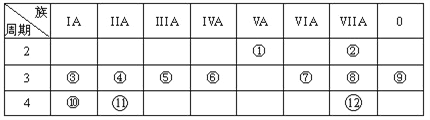
(1)在这些元素中,最活泼的金属元素和最活泼的非金属元素分别是____、______。(用元素符号作答)
(2)在这些元素的最高价氧化物对应水化物中,有一种呈两性的用来治疗胃酸过多反应的化学方程式______。
(3)在这些元素中,某元素的最高价氧化物对应的水化物可以和其气态氢化物反应,写出该化学方程式________。
(4)如何验证元素⑦与⑧的非金属性强弱,写出可以验证该结论的一个离子反应方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有0.1 mol电子转移,则生成0.1 mol NaOH
D.镀层破损后,镀锌铁板比镀锡铁板更易腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol某烃能与2mol HCl完全加成,其产物最多能被8mol Cl2完全取代,则原烃可能为
A. 乙炔 B. 环丁烯
C. 1一丙炔 D. 1,3一丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种有色溶液与SO2气体作用均能褪色,其实质相同的是
①酸性高锰酸钾溶液 ②品红溶液 ③溴水 ④滴有酚酞的氢氧化钠溶液
A. ①③ B. ②③ C. ①④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. NO的摩尔质量为30g
B. 常温常压下,14g一氧化碳所占体积为11.2 L
C. 等物质的量的Na2O2 和Na2O中所含阴阳离子总数相等
D. 设阿伏加德罗常数为NA,常温常压下O2与O3的混合物32g,含有分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com