
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
| 实验装置 |  |  |  |  |
| 部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
C
解析试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。a极质量减小,b极质量增加,这说明a电极是负极,失去电子,b电极是正极,溶液中的铜离子得到电子,则金属性是a>b。b电极有气体产生,c极无变化,这说明b的金属性强于c的;d极溶解,c极有气体产生,这说明d电极是负极,c电极是正极,溶液中的氢离子放电,生成氢气,则金属性是d>c;电流计指示在导线中电流从a极流向d极,这说明d电极是负极,a电极是正极,则金属性是d>a,所以这四种金属的活动性顺序是d>a>b>c,答案选C。
考点:考查原电池的应用;金属性强弱比较
点评:该题是高考中的常见题型,属于中等难度的试题。主要是考查对原电池原理,以及灵活运用原电池判断金属性强弱的熟悉了解程度,旨在培养学生分析、归纳和总结问题的能力。该题的关键是明确原电池的工作原理,然后结合题意和装置图灵活运用即可。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的化学方程式为:KI+3H2O KIO3+3H2↑。下列有关说法不正确的是
KIO3+3H2↑。下列有关说法不正确的是
| A.电解时,石墨作阳极,不锈钢作阴极 |
| B.电解时的阳极电极反应式:I-?6e-+3H2O = IO3-+6H+ |
| C.当电解过程中转移3 mol e-时,理论上可制得KIO3 107 g |
| D.电解一段时间后,电解质溶液的pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
原电池产生电流的本质原因是( )
| A.原电池中溶液能电离出自由移动的离子 |
| B.有两根导线将两个活泼性不同的电极连接 |
| C.电极上进行的氧化还原反应的生成物为电子 |
| D.电极上进行的氧化还原反应中会有电子的转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将铁片和银片用导线连接置于同一稀盐酸中,经过一段时间后,下列叙述正确的是
| A.负极有Cl2逸出,正极有H2逸出 | B.负极附近Cl-的浓度逐渐减小 |
| C.正极附近Cl-的浓度逐渐增大 | D.溶液中Cl-的浓度基本不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
| | M | N | P |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸溶液 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铁 | 硝酸铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将锌片和铜片用导线连接后平行放入稀硫酸中,发生原电池反应,下列叙述错误的是
| A.溶液的pH增大 |
| B.溶液中的Zn2+浓度增大 |
| C.溶液中的SO42— 浓度增大 |
| D.溶液的密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(共10分)如图装置中,已知A、B两池溶液的体积均为200mL: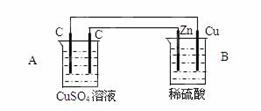
(1)判断装置的名称:A池为 ;
(2)A池中左边石墨棒为 极,
电极反应式为 ;
A池中总反应化学方程式为 ;
(3)若反应开始时,CuSO4溶液的浓度为1.0mol/L。工作一段时间后取出电极,测得导线上通过了0.04mole-。则反应后A池c(Cu2+)为 mol/L(体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)(1)为了验证Fe3 +与Cu2+氧化性强弱,下列装置能达到实验目的的是___________
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
①_______处电极入口通甲烷(填A或B),其电极反应式为_______________________________
_________________________________________
②当消耗甲烷的体积为22.4L(标准状况下)时, 假设电池的能量转化率为100%,则导线中转移电子的物质的量为 ,消耗KOH的物质的量为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com