
| A. | 被氧化的元素与被还原的元素的质量比为1:1 | |
| B. | NaBH4既是氧化剂又是还原剂 | |
| C. | NaBH4是还原剂,水是氧化剂 | |
| D. | B被氧化,H被还原 |
分析 在NaBH4+2H2O=NaBO2+4H2↑反应中,NaBH4中H元素的化合价为-1价,H2O中H元素的化合价为+1价,二者发生氧化还原反应,其中NaBH4是还原剂,H2O是氧化剂.
解答 解:A、化合价升高的元素是NaBH4中的氢元素,被氧化,水中的氢元素被还原,氧化剂和还原剂中H元素的化合价变化数值相同,物质的量之比为1:1,被氧化的元素与被还原的元素质量比为1:1,故A正确;
B、NaBH4中氢元素的化合价升高,所以NaBH4是还原剂,故B错误;
C、NaBH4中氢元素的化合价升高,所以NaBH4是还原剂,水中氢元素化合价降低,所以水是氧化剂,故C正确;
D、NaBH4中氢元素的化合价升高,被氧化,硼元素化合价不变,故D错误.
故选AC.
点评 本题考查氧化还原反应,题目难度不大,本题注意反应中各元素的变化,根据化合价的变化计算电子转移的数目.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

 和
和 E、CH3CH2CH2CH3和
E、CH3CH2CH2CH3和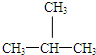
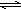 HCO3-+OH-
HCO3-+OH- 的系统命名为:3-甲基-4-乙基-庚烷
的系统命名为:3-甲基-4-乙基-庚烷 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验:
甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水呈浅黄绿色,久置的氯水无色 | |
| B. | 新制的氯水漂白作用强,而久置的氯水漂白作用很弱 | |
| C. | 新制的氯水所含成分多,而久置的氯水所含成分少 | |
| D. | 新制的氯水中无氯离子,而久置的氯水中则含氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验使用的主要仪器是分液漏斗 | |
| B. | 溶质溶于萃取剂中所得的溶液不一定有颜色 | |
| C. | 溶质在萃取剂中的溶解度比在原溶剂中的溶解度大 | |
| D. | CCl4、苯、汽油、酒精均可萃取碘水中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com