
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
A.1∶4 B.1∶2
C.2∶1 D.4∶1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列关于醇的物理性质的说法中正确的是( )
A.“酒香不怕巷子深”的说法说明了乙醇容易挥发
B.所有的醇在常温下均为液态
C.醇类物质都易溶于水,并且随着分子内羟基数目的增多,溶解性增强
D.由于醇分子中存在氢键,使得相对分子质量相近的醇比烷烃的熔沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B.CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大
C.Ca(HCO3)2溶液与过量NaOH溶液反应可得到Ca(OH)2
D.25 ℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
关于常温下,pH=2的醋酸溶液的叙述正确的是( )
A.c(CH3COOH)=0.01 mol/L
B.c(H+)=c(CH3COO-)
C.加水稀释100倍后,pH=4
D.加入醋酸铵固体,可抑制醋酸的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求回答下列问题:
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100 mL 3 mol/L的NaOH溶液吸收标准状况下4.48 L CO2时,所得溶液中各离子浓度由大到小的顺序为______________________________________________。
(2)常温下,向一定体积的0.1 mol/L的醋酸溶液中加水稀释后,下列说法正确的是________。
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中 不变
不变
D.溶液中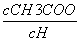 减小
减小
(3)①常温下将0.15 mol/L的稀硫酸V1 mL与0.1 mol/L的NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=__________(溶液体积的变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是__________。
A.若混合后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,混合后溶液的pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1 mol/L的下列五种溶液的pH如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是__________。
A.HCN B.HClO
C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是________。
A.CH3COOH+Na2CO3===NaHCO3+CH3COONa
B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2+H2O+2NaClO===Na2CO3+2HClO
D.NaHCO3+HCN===NaCN+H2O+CO2↑
(5)几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]________Ksp[Mg(OH)2](填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一种酸性溶液中,可能存在NO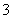 、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下的推测中不正确的是( )
、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下的推测中不正确的是( )
A.一定有碘离子 B.可能含铁离子
C.可能有氯离子 D.不含硝酸根离子
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500°C生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10
10C+P4O10===P4(白磷)+10CO
每生成1 mol P4时,就有________mol电子发生转移。
(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
□Ce3++□H2O2+□H2O===□Ce(OH)4↓+□________。
解析:(1)反应过程中磷酸钙最终变成了白磷,磷的化合价由+5价变成0价,由此可以得到 如下关系式:2Ca3(PO4)2~P4~20e-,所以每生成1 mol P4,转移20 mol电子;
如下关系式:2Ca3(PO4)2~P4~20e-,所以每生成1 mol P4,转移20 mol电子;
(2)分析反应可知,C e元素化合价由+3升高到+4,H2O2中氧元素化合价由-1降低到-2,根据得失电子守恒可确定Ce3+的化学计量数为2,H2O2的化学计量数为1,再根据电荷守恒可知缺少的物质为H+,最后根据原子守恒配平。
e元素化合价由+3升高到+4,H2O2中氧元素化合价由-1降低到-2,根据得失电子守恒可确定Ce3+的化学计量数为2,H2O2的化学计量数为1,再根据电荷守恒可知缺少的物质为H+,最后根据原子守恒配平。
查看答案和解析>>
科目:高中化学 来源: 题型:
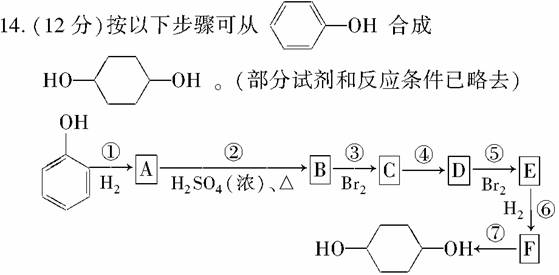
请回答下列问题:
(1)分别写出B、D的结构简式:
B.__________________________________________________,
D.__________________________________________________。
(2)反应①~⑦中属于消去反应的是__________。(填反应代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到E的可能的结构简式为:____________________________________________________。
(4)试写出C―→D反应的化学方程式(有机物写结构简式,并注明反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如下图所示,其中B、D、E的结构中均含有2个—CH3,它们的核磁共振氢谱中均出现4个峰。请回答:

(1)D的分子式为 ;
(2)E中所含官能团的名称为 ;
(3)Ⅲ的反应类型为 (填字母序号);
a.还原反应 b.加成反应 c.氧化反应 d.消去反应
(4)C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为 ;
(5)E有多种同分异构体,其中一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com