
【题目】2.4g Mg与100mL稀硫酸完全反应,反应前后溶液体积变化忽略不计.
求:(1)产生的气体在标准状况下的体积.
(2)反应完全后,所得溶液中镁离子的物质的量浓度.
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】将一定质量的Na、Na2O、Na2O2的混合物与足量水反应,在标准状况下得到6.72L 混合气体,将混合气体用电火花引燃,恰好完全反应,则Na与Na2O2的物质的量之比为
A. l : 2 B. 1 : 1 C. 2 : 1 D. 3 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是

A.③元素形成的单质晶体均属于原子晶体
B.②、⑦、⑧对应的简单离子半径依次减小
C.②⑤形成的化合物阴阳离子个数比可能为1∶1
D.④元素的气态氢化物易液化,是因为其分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常见的A-J物质存在如下转化关系示意图(反应条件己略去),
已知通常情况下A、H 为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀.请回答下列问题:
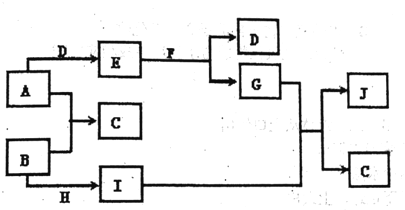
(1)写出下列物质的化学式:A_____;C____; J ______;
(2)转化I+G![]() J+C的反应类型为______。
J+C的反应类型为______。
(3)E中阴阳离子个数比与_______相同(填字母)
a.MgCl2 b.Na2O c.NaCl d.K2SO4
(4)写出下列反应的化学方程式:
① E+F![]() ________;
________;
② B+G![]() _________。
_________。
(5)写出E的一种用途:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中存在有五种离子,其中各离子个数比Cl-∶SO42-∶Fe3+∶K+∶M=2∶3∶1∶3∶1,则M为( )
A.CO32- B.Mg2+ C.Na+ D.Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究在加热条件下FeSO4分解的气体产物及相关性质。已知:SO2的沸点为-10℃、SO3的沸点为44.8℃。
Ⅰ.用如图所示装置设计实验,验证分解FeSO4生成的气态产物。

(1)实验前必须进行的操作是_______________________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:a→_________________。
(3)若观察到装置丙中有无色液体产生,装置丁中溶液变成无色,则 FeSO4分解的化学方程式为____________________。
Ⅱ.为探究SO2使品红溶液褪色的原理,进行如下实验:
实验1:将稀盐酸和NaOH溶液分别滴入品红水溶液中。观察到前者溶液颜色变浅,但未能完全褪色,后者溶液颜色几乎不变。
实验2:在滴有稀盐酸和NaOH溶液的两份品红水溶液中分别通入SO2。观察到前者溶液逐渐褪色,后者溶液很快褪色。
实验3:在两份品红水溶液中分别加入一小粒Na2SO3固体和NaHSO3固体,前者溶液很快褪色,后者溶液褪色很慢。
(1)由实验1可推测品红水溶液呈________性。
(2)由实验2、3可推知,使品红水溶液褪色的主要微粒是_________(填化学式)。
(3)若将SO2通入品红的无水乙醇溶液,试预测可能出现的现象________________。
(4)加热溶有Na2SO3的品红水溶液,发现不能恢复红色,试解释原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A. 酸性高锰酸钾溶液可用来鉴别乙烷和乙烯
B. 烃分子中都含有极性键和非极性键
C. ![]() 分子中至少11个碳原子处于同一平面
分子中至少11个碳原子处于同一平面
D. 利用灼烧的方法可鉴别蚕丝和棉制品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/10-3 mol·L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B.因该反应熵变(ΔS)大于0,焓变(ΔH)大于0,所以在低温下自发进行
C.根据表中数据,计算15.0 ℃时的分解平衡常数约为2.0×10-9
D.达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com