
分析 (1)首先写出反应的化学方程式,即2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g),然后利用盖斯定律计算所需热化学方程式;
(2)①原电池负极发生氧化反应,二甲醚在负极放电,酸性条件下生成二氧化碳碳,正极是氧气得到电子在酸性溶液中生成水,结合电荷守恒和原子守恒书写电极反应;
②电极饱和食盐水生成氢氧化钠、氯气和氢气;
③根据电解氯化钠溶液的电解方程式来求溶液的pH,结合电极反应和电子守恒计算消耗二甲醚的质量.
解答 解:(1)利用盖斯定律进行计算,将三个方程式进行形式变换,
①CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ/mol
②CO(g)+H2O(g)═CO2(g)+H2(g)△H2=-41.1kJ/mol
③2CH3OH(g)═CH3OCH3(g)+H2O(g)△H3=-24.5kJ/mol
盖斯定律计算①×2-2×②+③得到:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=-122.5 kJ•mol-1
故答案:-122.5 kJ•mol-1;
(2)①正极上是氧气得到电子发生还原反应,在酸性溶液中生成生成水,电极反应为:O2+4e-+4H+=2H2O,原电池负极发生氧化反应,二甲醚在负极放电,酸性条件下生成二氧化碳,电极反应式为:CH3OCH3-12e-+3H2O=2CO2+12H+;
故答案为:O2+4e-+4H+=2H2O,CH3OCH3-12e-+3H2O=2CO2+12H+;
②电极饱和食盐水阳极氯离子失电子发生氧化反应生成氯气,阴极氢离子得到电子发生还原反应生成氢气,同时溶液中生成氢氧化钠,反应的化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
③由方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
2 22.4
0.2mol 2.24L
由题可知:之后反应为直接电解水,溶液pH值不改变,c(H+)=$\frac{1{0}^{-14}}{\frac{0.2mol}{0.2L}}$=10-14,所以pH=14,
电解过程中电子转移总数为0.2mol,结合电极反应和电子守恒计算CH3OCH3-12e-+3H2O=2CO2+12H+,消耗甲醚物质的量=$\frac{0.2}{12}$mol,
质量=$\frac{0.2}{12}$mol×46g/mol=0.8g,
故答案为:14;0.8 g;
点评 本题考查用盖斯定律进行有关反应热的计算、盐类水解的应用、原电池和电解池原理的应用等知识,掌握电极反应书写和电子守恒的计算是解题的关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 向0.10mol/L NH4HCO3中溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 向0.10mol/L NaHSO3中溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol/L Na2SO3中溶液中通入SO2:c(Na+)=2[c(H2SO3)+c(HSO3-)+c(SO32-)] | |
| D. | 向0.10mol/L CH3COONa中溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用氢氧化钠溶液除去镁粉中的铝粉:2Al+2OH-═AlO2-+H2↑ | |
| B. | 向碳酸氢钠溶液中加入少量氢氧化钙:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氧化铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | Na2S溶液显碱性:S2-+H2O?HS-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
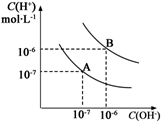 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KIO3与KI在酸性溶液中反应:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向碳酸氢铵溶液中加过量氢氧化钠溶液并加热:NH4++OH-═NH3↑+H2O | |
| C. | Na[Al(OH)4]-溶液中通入过量CO2制Al(OH)3:CO2+[Al(OH)4]-═Al(OH)3↓+HCO3- | |
| D. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子中含有羟基 | |
| B. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| C. | 75%的乙醇溶液常用于医疗消毒 | |
| D. | 只用水无法鉴别苯和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | NH3分子的电子式: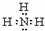 | ||
| C. | 铝原子的结构示意图: | D. | 聚丙烯的结构简式为: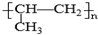 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色褪去可证明BaCl2溶液显酸性 | |
| B. | 根据盐溶液的酸碱性,将盐分成酸式盐、正盐和碱式盐 | |
| C. | 泡沫灭火器是利用硫酸铝溶液和碳酸钠溶液反应产生大量CO2和Al(OH)3灭火 | |
| D. | NH4F溶液中含有少量的HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数为NA的CO和C2H4混合气体的体积约为22.4 L | |
| B. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA | |
| C. | 用MnO2与浓盐酸制取Cl2时,每生成0.5mol Cl2则转移电子数为NA | |
| D. | 0.1 L 3.0 mol•L-1的NH4NO3溶液中含有NH${\;}_{4}^{+}$的数目为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com