
| A. | 1.5mol/L | B. | 3.0mol/L | C. | 2.0mol/L | D. | 无法计算 |
分析 Fe有剩余,反应生成Fe(NO3)2,参加反应反应Fe为4.2g,由于Fe在浓硝酸中发生钝化,故应是Fe与稀硝酸反应生成NO,根据电子转移守恒计算NO物质的量,再根据氮原子守恒计算硝酸物质的量,进而计算硝酸的浓度.
解答 解:Fe有剩余,反应生成Fe(NO3)2,参加反应反应Fe为4.2g,参加反应Fe为$\frac{4.2g}{56g/mol}$=0.075mol,由于Fe在浓硝酸中发生钝化,故应是Fe与稀硝酸反应生成NO,根据电子转移守恒,生成NO为$\frac{0.075mol×2}{3}$=0.05mol,根据N原子守恒,则n(HNO3)=2n[Fe(NO3)2]+n(NO)=2×0.075mol+0.05mol=0.2mol,故该硝酸的浓度为$\frac{0.2mol}{0.1L}$=2mol/L,
故选:C.
点评 本题考查化学方程式计算、硝酸的性质,属于易错题目,学生容易忽略Fe在浓硝酸中发生钝化,认为生成的气体不能确定,而认为题目无法计算.


科目:高中化学 来源: 题型:选择题
| A. | NH4Cl溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | Na2SO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| C. | NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | 等体积、等物质的量浓度的CH3COONa和弱酸CH3COOH混合后的溶液中:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| B. | SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 氯化铝是一种电解质,可用于电解制铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 | |
| B. | 推广燃煤发电,停建核电站,以防核泄漏事故发生 | |
| C. | 设计绿色化工工艺,提高反应的选择性和原子利用率 | |
| D. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 向氯水中加入淀粉KI溶液 | 溶液变蓝 | 氯水中含有氯气分子 |
| Ⅱ | 将氯水滴入AgNO3溶液 | 产生白色沉淀 | 氯气与水反应的产物中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
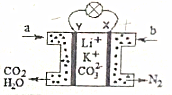 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH3OH为燃料时,该电池工作原理如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH3OH为燃料时,该电池工作原理如图.下列说法正确的是( )| A. | b为空气,电子由X极经导线流向Y极 | |
| B. | 在熔融电解质中,CO32-向X极移动 | |
| C. | 消耗1molCH3OH,消耗氧气分子数目约为3×6.02×1023 | |
| D. | 正极反应式为:O2+2CO2+4e-═2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
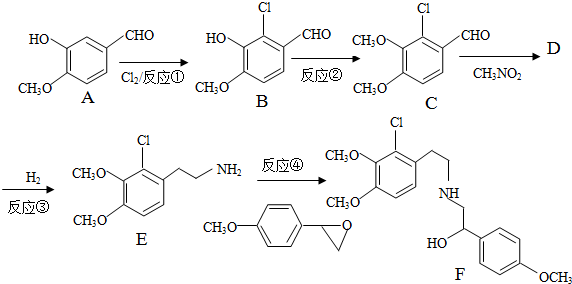
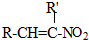 +H2O
+H2O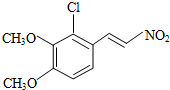 ,反应③中1摩尔D需要4摩尔H2才能转化为E
,反应③中1摩尔D需要4摩尔H2才能转化为E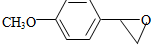 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式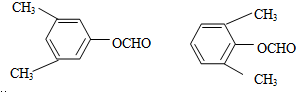 .
.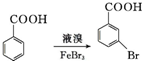 .写出以
.写出以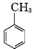 为原料制备
为原料制备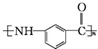 的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)
的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
| 浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
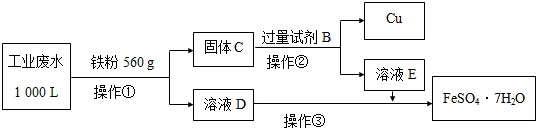
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com