
| A、工业上常通过电解熔融的MgO冶炼金属镁 |
| B、将NaOH溶液逐滴加入FeCl3溶液可制备Fe(OH)3胶体 |
| C、牡丹籽油是一种优良的植物油脂,它可使酸性高锰酸钾溶液褪色 |
| D、溴水不能区别四种有机溶剂:苯、四氯化碳、己烯、无水乙醇 |
| ||


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
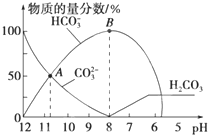 常温下,在10mL 0.1mol?L-1 Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL 0.1mol?L-1 Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )| A、在0.1 mol?L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| B、当溶液的pH为7时,溶液的总体积为20 mL |
| C、在B点所示的溶液中,浓度最大的阳离子是Na+ |
| D、在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3 | B、3:2 |
| C、1:3 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(N2)正=v(NH3)逆 |
| B、单位时间内3molH-H键断裂,同时6mol N-H键断裂 |
| C、n(N2):n(H2):(NH3)=1:3:2 |
| D、反应混合物各组分的物质的量浓度还在改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,在空气中能产生丁达尔现象 |
| B、在海轮外壳上镶嵌锌块,会减缓船体的锈蚀 |
| C、经过必要的化学变化能从海水中提取NaCl、Mg、Br2等物质 |
| D、大量燃烧化石燃料排放的废气中大量CO2、SO2,造成大气污染,从而使雨水的PH=5.6形成酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
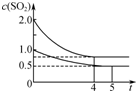 向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g);△H=-197.74kJ?mol-1.
向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g);△H=-197.74kJ?mol-1.| A、热量:Q(甲)<2Q(乙) |
| B、压强:p(甲)<2p(乙) |
| C、乙中前5 min内的反应速率v(O2)=0.10 mol?L-1?min-1 |
| D、保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2 mol O2、0.4 mol SO3,则此时v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:
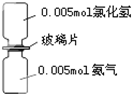 如图是氨气与氯化氢反应的装置.抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )
如图是氨气与氯化氢反应的装置.抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )| A、气体反应物的总体积为0.224L |
| B、产物中所含的N-H键个数为0.02NA |
| C、生成物中含有0.005NA个分子 |
| D、加1L水溶解后所得溶液中阳离子浓度为0.005mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石英坩埚耐高温,可用来加热熔化NaOH固体 |
| B、浓硫酸有脱水性,可用作干燥剂 |
| C、二氧化硫有漂白性,可大量用于加工食品使食品漂白 |
| D、医用酒精能使蛋白质变性,可用来消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
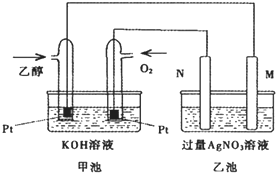 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com