
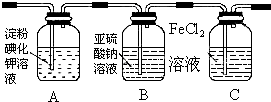
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量2 mol/LHCl和1 mol/LBaCl2溶液,振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加过量l mol/LBa(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中,滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在Cl- |
分析 (1)氯气有氧化性,能和碘化钾反应生成碘单质,能与氯化亚铁反应生成氯化铁;
(2)步骤1:除去亚硫酸根离子,检验硫酸根离子,步骤2:除去亚硫酸根离子和硫酸根离子,步骤3:检验氯离子;
解答 解:(1)氯气有氧化性,能和碘化钾反应生成碘单质,碘遇淀粉变蓝色.能与氯化亚铁反应生成氯化铁,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,
故答案为:溶液变蓝色;2Fe2++Cl2═2Fe3++2Cl-;
(2)步骤1:除去亚硫酸根离子,可用过量2 mol/LHCl,检验硫酸根离子,可用1 mol/LBaCl2溶液,若产生的白色沉淀,则洗气瓶B溶液中存在SO42-,
故答案为:过量2 mol/LHCl和1 mol/LBaCl2溶液,振荡;
步骤2:除去亚硫酸根离子和硫酸根离子,可用过量1 mol/LBaCl2溶液,
故答案为:过量l mol/LBa(NO3)2溶液,振荡,静置;
步骤3:检验氯离子,可用0.1mol/LAgNO3溶液和过量的2mol/LHNO3,若产生白色沉淀,则洗气瓶B溶液中存在Cl-,
故答案为:0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡;若产生白色沉淀,则洗气瓶B溶液中存在Cl-;
点评 本题考查了氯气的性质、氯离子和硫酸根离子的检验,难度中等.要注意掌握常见阴离子的检验方法和操作步骤.


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 红磷与白磷 | B. | 甲烷与乙烷 | C. | ${\;}_{1}^{1}$H与${\;}_{1}^{2}$H | D. | 正丁烷与异丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 方框中的物质应为 Cu2S | |
| B. | 若有1 molSO2生成,则反应中有4 mol 电子转移 | |
| C. | SO2既是氧化产物又是还原产物 | |
| D. | O2只作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 主要成分:25% NaClO、1000mL、密度1.198g•cm-3 使用方法:稀释100倍(体积比)后使用 注意事项:密封保存,易吸收空气中CO2的变质 |
| A. | 该“84消毒液”的浓度为4.0mol•L-1 | |
| B. | 一瓶该“84消毒液”可能吸收CO2 44.8L(标况) | |
| C. | 稀释后的“84消毒液”中c(Na+)约为0.04 mol•L-1 | |
| D. | 若用NaClO 固体配制480mL含25%NaClO“84消毒液”,需要称量NaClO固体143g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| O<N | Cl<F | NaCl<CaO | HF>HCl |
| 共价键 | H-Cl | O=O | H-O | Cl-Cl |
| 键能/kJ•mol-1 | 431 | 498 | 463 | 243 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 转化率(%) | 0.1MPa | 0.5MPa | 1.0MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com