
分析 (1)碳酸钙与盐酸反应生成氯化钙和氢气;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(3)铜与浓硝酸反应生成硝酸铜、二氧化氮和水;
(4)向NaHCO3溶液中加入过量的石灰水,反应生成碳酸钙、氢氧化钠和水;
(5)向NaHSO4溶液中滴加Ba(OH)2至中性生成硫酸钠、硫酸钡和水,再加氢氧化钡,钡离子与硫酸根离子反应生成硫酸钡沉淀.
解答 解:(1)碳酸钙与盐酸反应生成氯化钙和氢气,离子方程式:CaCO3+2H+═Ca2++H2O+CO2↑;
故答案为:CaCO3+2H+═Ca2++H2O+CO2↑;
(2)实验室制取Cl2反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,离子方程式:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(4)向NaHCO3溶液中加入过量的石灰水,反应生成碳酸钙、氢氧化钠和水,离子方程式:HCO3-+Ca2++OH-═CaCO3↓+H2O;
故答案为:HCO3-+Ca2++OH-═CaCO3↓+H2O;
(5)向NaHSO4溶液中滴加Ba(OH)2至中性生成硫酸钠、硫酸钡和水,离子方程式:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O;
再加氢氧化钡,钡离子与硫酸根离子反应生成硫酸钡沉淀,离子方程式:Ba2++SO42-═BaSO4↓;
故答案为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O;Ba2++SO42-═BaSO4↓.
点评 本题考查化学反应及离子反应的书写,为高频考点,把握物质的性质及反应物、生成物为解答的关键,注意反应物用量对反应的影响,题目难度不大.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4H与水反应时,NH4H是还原剂 | B. | NH4H溶于水时,溶液显酸性 | ||
| C. | H-的离子半径小于Li+的离子半径 | D. | NH4H中只有离子键没有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO中毒者移至通风处抢救 | |
| B. | 误食硫酸铜溶液,可服用氢氧化钠溶液解毒 | |
| C. | 浓H2SO4溅到皮肤上,立即用碳酸钠稀溶液洗涤 | |
| D. | 氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 mL容量瓶 | B. | 胶头滴管 | C. | 分液漏斗 | D. | 烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 烷烃 | CH4 | CH3CH3 | CH3CH2CH3 | C4H10 | |
| CH3CH2CH2CH3 | CH(CH3)3 | ||||
| 核磁共振氢谱吸收峰 | 1种 | 1种 | 2种 | 2种 | 2种 |
| 一氯代物或烷烃基 | 1种 | 1种 | 2种 | 4种 | |
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
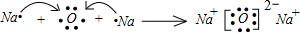 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其它条件不变,加入催化剂,△H变大 | |
| B. | 及时除去二氧化碳,能使NO完全转化 | |
| C. | 充入氦气使体系压强增大,可提高反应物的转化率 | |
| D. | 若升高温度,该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA | |
| B. | 标准状况下,1.12L氦气所含原子数为0.1NA | |
| C. | 17gNH3所含电子数目为NA | |
| D. | 22.4LHCl溶于水,溶液中H+数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com