
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源:2015-2016学年辽宁师大附中高一上10月月考化学试卷 (解析版) 题型:选择题
在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后
A.整个溶液变紫色 B.整个溶液变为棕黄色
C.上层几乎无色,下层为紫红色 D.下层无色,上层紫红色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东济南外国语学校高一上期中化学试卷(解析版) 题型:选择题
常用两种方法制备氯化物:①金属与氯气直接化合;②金属与盐酸反应。用上述两种方法都可制得的氯化物是
A.CuCl2 B.FeCl2
C.FeCl3 D.AlCl3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古包头九中高一上10月月考化学试卷(解析版) 题型:选择题
同温同压下,50mL气体A2和100mLB2化合生成50mL气体C,则C的化学式为:
A.AB B.AB2 C.A2B D.A2B4
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上期中测试化学试卷(解析版) 题型:实验题
(10分)某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol•L﹣1的盐酸标准溶液吸收.蒸氨结束后取下接收瓶,用c2 mol•L﹣1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液.
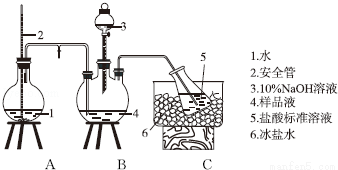
氨的测定装置(已省略加热和夹持装置)
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用_____________式滴定管,可使用的指示剂为____________。
(3)样品中氨的质量分数表达式为_____________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将__________(填“偏高”或“偏低”)。
(5)测定氯过程中,使用棕色滴定管的原因是_________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol•L﹣1,c(CrO42-)为__________mol•L-1。已知:Ksp(Ag2CrO4)=1.12×10-12
(6)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,钴的化合价__________,制备X的化学方程式为__________;X的制备过程中温度不能过高的原因是__________。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上期中测试化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的作用。下列说法中不正确的是
A.Na2FeO4能与水缓慢反应生成Fe(OH)3和O2,故可用作水的消毒剂和净化剂
B.钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用
C.常温下氨能与氯气反应生成氯化氢和氮气,因此可用浓氨水检查氯气管道泄漏情况
D.开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京大学附属中学分校高二上抽考化学试卷(解析版) 题型:选择题
合成氨反应:N2(g)+3H2(g)  2NH3(g) ΔH =-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g) ΔH =-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:
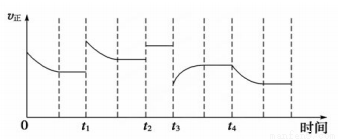
下列说法正确的是
A.t1时升高了温度 B.t2时使用了催化剂
C.t3时增大了压强 D.t4时降低了温度
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上期中测试化学试卷(解析版) 题型:选择题
实验室需配置一种仅含四种离子(不考虑水电离出来的离子)的无色混合溶液,且在混合物溶液中四种离子的浓度均为1mol/L。下列四个选项中能达到此目的的是
A.Na+、K+、SO42-、Cl- B.Cu2+、K+、SO42-、NO3-
C.H+、K+、HCO3-、Cl- D.Mg2+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第三次月考化学试卷(解析版) 题型:填空题
金刚石、SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与短周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子。碳元素在周期表中的位置是 ,Q是 ,R的电子式为 ;
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收其中的CCl4的实验操作名称为 ,除去粗产品中少量钠的试剂为 ;
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2.现将20.0g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,生成氢气的离子方程式为 ,将滤液稀释到1L,若所得Na2SiO3的物质的量浓度为0.17mol· L-1,则SiC的纯度为_____________;
(4)下列叙述正确的有 (填序号)
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
③钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1∶2
④水晶、干冰熔化时克服粒子间作用力的类型相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com