
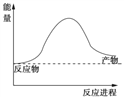
【题目】氨在工农业生产中应用广泛。
(1)根据下图写出合成氨的热化学方程式是________________________。

(2)将1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___________(填“大于”、“等于”或“小于”)92.2 kJ,原因是______________;若加入催化剂,ΔH________(填“变大”、“不变”或“变小”)。
(3)已知分别破坏1 mol N≡N键、1 mol H-H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为________kJ。
(4)N2H4可视为NH3分子中的H被-NH2取代的产物。发射卫星时以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)==2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)==N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
则1 mol N2H4与NO2完全反应的热化学方程式为_______________。
【答案】(1)N2(g)+3H2(g)![]() 2NH3(g)△H=-92.2kJ/mol
2NH3(g)△H=-92.2kJ/mol
(2)小于;该反应是可逆反应,反应物无法全部转化为生成物;不变;(3)391
(4)N2H4(g)+NO2(g)=3/2N2(g)+2H2O(g)△H=-567.85 kJmol-1
【解析】
试题分析:(1)由图可知,0.5molN2(g)与1.5molH2(g)完全反应生成1molNH3(g)的反应热为-46.1kJ/mol,所以合成氨的热化学反应方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.2kJ/mol;
2NH3(g)△H=-92.2kJ/mol;
(2)反应是可逆反应,反应物不能完全转化,3mol H2和1mol N2充分参与反应也不可能生成2molNH3,故放出的热量小于92KJ的热量,催化剂改变反应速率不改变化学平衡,反应焓变不变;
(3)已知:分别破坏1mol N≡N键、1mol H-H键需要吸收的能量为:946kJ、436kJ,设破坏1mol N-H键需要吸收的能量为x,N2(g)+3H2(g)![]() 2NH3(g)△H=-92.2kJ/mol,焓变=反应物总键能-生成物的总键能,946kJ/mol+3×436kJ/mol-6x=92.2KJ/mol,x=391KJ/mol,破坏1mol N-H键需要吸收的能量为:391kJ;
2NH3(g)△H=-92.2kJ/mol,焓变=反应物总键能-生成物的总键能,946kJ/mol+3×436kJ/mol-6x=92.2KJ/mol,x=391KJ/mol,破坏1mol N-H键需要吸收的能量为:391kJ;
(4):①N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol
依据盖斯定律:②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ/mol,1mol
N2H4与NO2完全反应的热化学方程式为:N2H4(g)+NO2(g)=3/2N2(g)+2H2O(g)△H=-567.85 kJmol-1。


科目:高中化学 来源: 题型:
【题目】一个化学反应,我们不但要关心物质变化,还要研究能量变化和反应快慢。
(1)下面是一个由天然气和水反应制备氢气的反应,其方程式为:CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g)该反应过程中能量变化如图所示,则该反应为______反应(填“吸热”或“放热”),
CO2(g)+4H2(g)该反应过程中能量变化如图所示,则该反应为______反应(填“吸热”或“放热”),
若已知,破坏1mol化学键需要吸收的热量如下表所示:则该反应吸收或放出热量为______kJ (用含a b c d字母的代数式表示)。
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |
(2)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为________;X为__________。若反应经2min达到平衡,平衡时C的浓度______0.8mol/L(填“大于”,“小于”或“等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为__________。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为________;X为__________。若反应经2min达到平衡,平衡时C的浓度______0.8mol/L(填“大于”,“小于”或“等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )
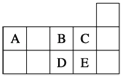
A. D在过量的B中燃烧的主要产物为DB3
B. C的氢化物的水溶液酸性比E的强
C. D与B形成的阴离子可能有DB32﹣、D2B42﹣
D. E单质中由于形成了氢键,所以很容易液化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积相同的容器中,一个盛有C3H8气体,另—个盛有N2O和CO2的混合气体。在同温同压下,两容器内的气体一定具有相同的①分子数②密度③质量④质子数⑤原子数
A. ①②③ B. ①②⑤ C. ③④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】橙花醇具有玫瑰及苹果香气,可作为香料。其结构简式如下:
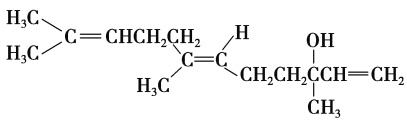
下列关于橙花醇的叙述,错误的是
A.既能发生取代反应,也能发生加成反应
B.橙花醇分子中有1个手性碳原子
C.橙花醇分子中所有碳原子有可能都在同一平面上
D.在浓硫酸催化下加热脱水,可以生成不止一种四烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C和D是同一周期的四种元素,A、B、C的原子序数依次相差1;A元素的单质化学性质最活泼,能与水直接发生反应.B元素的氧化物2.0g恰好跟100mL0.5mol/L的H2SO4完全反应.B元素的单质跟D元素单质反应生成BD2型化合物.根据以上事实回答:
(1)A原子的结构示意图为
(2)C在周期表中的位置:
(3)BD2含有的化学键类型为
(4)A、C两元素最高价氧化物的水化物相互反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种元素一个原子的质量为a g, 12C的一个原子质量是bg,NA是阿伏伽德罗常数的值。下列说法不正确的是( )
A. 由信息可知NA=![]()
B. 该原子的摩尔质量是aNA g/mol
C. w g该原子的物质的量一定是![]() mol
mol
D. w g该原子中含有![]() 个该原子
个该原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)煤化工通常通过研究不同温度下的平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:
CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
①若在500℃时进行反应,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为 。
②800℃时,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L, c(H2)=0.05mol/L ,则反应开始时,H2的消耗速率比生成速率 (填“大”、“小”或“不能确定”)。
(2)2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示:又已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99 kJ·mol-1,请回答问题:
2SO3(g)反应过程中的能量变化如图所示:又已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99 kJ·mol-1,请回答问题:
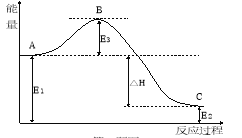
该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”或“降低” )△H (填“变大”、“变小”或“不变”);
(3)已知某反应的平衡常数表达式为:![]() ,它所对应反应的化学方程式为
,它所对应反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在10 mL浓度均为0.1 mol/LNaOH和NH3·H2O混合溶液中滴加0.1 mol/L盐酸,下列有关溶液中粒子浓度关系正确的是( )
A.未加盐酸时:c(OH-)>c(Na+)=c(NH3·H2O)
B.加入盐酸至溶液pH=7时:c(Cl-)=c(Na+)
C.加入10 mL盐酸时:c(NH![]() )+c(H+)=c(OH-)
)+c(H+)=c(OH-)
D.加入20 mL盐酸时:c(Cl-)=c(NH![]() )+c(Na+)
)+c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com