
I.高炉炼铁的主要反应为Fe2O3+3CO2Fe+3CO2。
已知该反应的 H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
(1)该时间范围内的平均反应速率v(CO2)=_________mol/L min
min
(2) 的最大转化率_________________。
(3)欲提高CO的平衡转化率,可采取的措施是_______________。
A.减少Fe的量 B.增加Fe2O3的量
C.升高反应温度 D.移出部分CO2
E.使用合适的催化剂 F.减少容器的容积
Ⅱ.已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
|
温度 |
K1 |
K2 |
|
973K |
1.47 |
2.38 |
|
1173K |
2.15 |
1.67 |
(4)通过表格中的数值可以推断:反应①的△H_ O。(填“>”“<”)
(5)现有反应③:该反应的平衡常数的数学表
达式K3=____。
(6)根据反应①和②可以推导出Ki,Kz和玛之间的关系式。K3=__________。据此关系式和上表数据,也能推断出反应③的△H_ _0(填“>”“<”)。
(14分)
(1)0.006 (2分)
(2)60% (2分)
(3)D (2分)
(4)> (2分)
(5) (2分)
(2分)
(6)K3=K1/K2 (2分) > (2分)
【解析】I.⑴在1000℃时,该反应的平衡常数K=64,在10L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K= =
= =64,计算得到x=0.6
=64,计算得到x=0.6
转化率=60%
v(CO2)= =0.006mol/L
=0.006mol/L min
min
故答案为:⑴0.006mol/L min⑵60%;
min⑵60%;
⑶A.铁是固体,减少Fe的量,不影响平衡移动,CO的平衡转化率不变,故A错误;
B.氧化铁是固体,增加Fe2O3的量,不影响平衡移动,CO的平衡转化率不变,故B错误;
C.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故C错误;
D.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故D正确;
E.加入合适的催化剂,平衡不移动,故E错误;
F.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故F错误;
故选D;
⑷由表中数据可知,温度升高,①的平衡常数增大,说明平衡向正反应方向移动,则正反应吸热,△H >0
故答案为:>;
⑸依据反应CO2(g)+H2(g) CO(g)+H2O(g),根据平衡常数的概念,该反应的平衡常数K3的数学表达式:K=
CO(g)+H2O(g),根据平衡常数的概念,该反应的平衡常数K3的数学表达式:K=
,故答案为:
(6)已知:①Fe(s)+CO2(g) FeO(s)+CO(g);
FeO(s)+CO(g);
②Fe(s)+H2O(g) FeO(s)+H2(g);
FeO(s)+H2(g);
利用盖斯定律将①-②可得:③H2(g)+CO2(g) CO(g)+H2O(g);
CO(g)+H2O(g);
则K3= =
=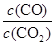 ÷
÷ =
= ;
;
依据图表平衡常数数据分析,温度升高 增大,说明平衡正向进行,反应是吸热反应;△H>0,
增大,说明平衡正向进行,反应是吸热反应;△H>0,
答案: ,>。
,>。
考点:化学反应速率,化学平衡原理及其应用


科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省湛江市普通高考测试(二)理综化学试卷(解析版) 题型:计算题
高炉炼铁是冶炼铁的主要方法。
(1)从炼铁高炉口排出的尾气中含有一定量的有毒气体 (填化学式),会污染空气。100多年前,人们曾耗巨资改建高炉,结果尾气中的该物质含量并未减少。高炉炼铁的主要反应方程式为(设铁矿石用磁铁矿) 。
(2)已知:①4Fe(s) + 3O2=2Fe2O3(s) ΔH1
②4Fe3O4(s)+O2(g)=6Fe2O3(s) ΔH2
③3Fe(s)+2O2(g)=Fe3O4(s) ΔH3
则ΔH2= (用含上述ΔH的代数式表示)。
(3)高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H2SO4、HNO3、KOH、NaOH、Na2SO4)溶液,原因是_____________,阳极反应式为_________________。
(4)某温度下,HX的电离平衡常数K为1×10-5。计算该温度下0.100mol/L的HX溶液的 H+浓度。(平衡时HX的浓度以0.100mol/L计,水的电离忽略不计,写出计算过程。)
查看答案和解析>>
科目:高中化学 来源: 题型:
 2Fe+3CO2,采用的方法为 ()。
2Fe+3CO2,采用的方法为 ()。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com