
下列说法或表达正确的是( )
①活性炭、SO2和HClO都具有漂白作用,且漂白的化学原理相同
②常温常压下,16 g O3所含的原子数为NA
③因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
④1 mol Cl2发生反应时,转移的电子数一定是2 NA
⑤碳酸氢根离子的电离方程式可表示为: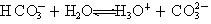
⑥元素周期表中,从上到下,卤族元素的非金属性逐渐减弱,氢卤酸的酸性依次减弱
⑦500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
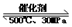 2NH3
(g) △H=-38.6kJ·mol-1
2NH3
(g) △H=-38.6kJ·mol-1
A.全部 B.②⑤ C.②③④⑦ D.②④⑦
B
【解析】
试题分析:①HClO有强氧化性而具有漂白性,SO2和有色物质发生化合反应而漂白,活性炭具有吸附性,则漂白原理不同,故①错误;②常温常压下,16g O3含有的氧原子质量为16g,含有的氧原子的物质的量为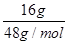 =1/3mol,即氧原子数为NA,故②正确;③非金属性Cl>S,可比较最高价含氧酸的酸性,不能比较HClO、稀H2SO4的氧化性,二者没有因果关系,故③错误;④氯气与强碱在加热条件下生成氯酸盐,如:3Cl2+6KOH
=1/3mol,即氧原子数为NA,故②正确;③非金属性Cl>S,可比较最高价含氧酸的酸性,不能比较HClO、稀H2SO4的氧化性,二者没有因果关系,故③错误;④氯气与强碱在加热条件下生成氯酸盐,如:3Cl2+6KOH 5KCl+KClO3+3H2O,故④错误;⑤碳酸氢根离子电离产生氢离子,电离方程式:HCO3-+H2O
5KCl+KClO3+3H2O,故④错误;⑤碳酸氢根离子电离产生氢离子,电离方程式:HCO3-+H2O H3O++CO32-,故⑤正确;⑥从上到下,卤族元素的非金属性逐渐减弱,气态氢化物的稳定性减弱,其水溶液中氢卤酸的酸性依次增强,故⑥错误;⑦0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,故⑦错误
H3O++CO32-,故⑤正确;⑥从上到下,卤族元素的非金属性逐渐减弱,气态氢化物的稳定性减弱,其水溶液中氢卤酸的酸性依次增强,故⑥错误;⑦0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,故⑦错误
考点:非金属在元素周期表中的位置及其性质递变规律;电离方程式的书写;质量数与质子数中子数之间的互相关系;热化学方程式;氧化还原反应。


科目:高中化学 来源: 题型:
 已知25℃、101kPa下,如图所示,石墨的燃烧热为393.51kJ/mol,金刚石的燃烧热为395.41kJ/mol.下列说法或表达正确的是( )
已知25℃、101kPa下,如图所示,石墨的燃烧热为393.51kJ/mol,金刚石的燃烧热为395.41kJ/mol.下列说法或表达正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 500℃.30MPa |
| A、全部 | B、②⑤ |
| C、②③④⑦ | D、②④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知25℃、101kPa下,如图所示,石墨的燃烧热为393.5kJ/
已知25℃、101kPa下,如图所示,石墨的燃烧热为393.5kJ/| A、金刚石比石墨稳定 | B、C(s、石墨)=C(s、金刚石)△H=+1.5kJ/mol | C、△H1<△H2 | D、如果使用催化剂,△H1和△H2都变小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com