
【题目】设NA为阿伏加德罗常数的数值。下列说法不正确的是
A. 23gCH3CH2OH与30gCH3COOH反应,生成CH3COOCH2CH3的分子数为0.5NA
B. 15.6g由Na2S和Na2O2组成的混合物中,含有的阴离子数目为0.2NA
C. 32.5g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.5NA
D. 过量MnO2与浓盐酸反应产生1molCl2,转移的电子数目为2NA
【答案】A
【解析】分析:A项,CH3CH2OH与CH3COOH的酯化反应为可逆反应;B项,Na2S和Na2O2的摩尔质量都是78g/mol,Na2S和Na2O2中阴、阳离子个数比都为1:2;C项,Zn与浓H2SO4反应生成SO2,随着反应的进行硫酸变稀,Zn与稀硫酸反应生成H2;D项,Cl元素的化合价由-1价升至0价,生成1molCl2失去2mol电子。
详解:A项,n(CH3CH2OH)=![]() =0.5mol,n(CH3COOH)=
=0.5mol,n(CH3COOH)=![]() =0.5mol,CH3CH2OH与CH3COOH反应的化学方程式为CH3CH2OH+CH3COOH
=0.5mol,CH3CH2OH与CH3COOH反应的化学方程式为CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O,由于该反应为可逆反应,生成的CH3COOCH2CH3物质的量小于0.5mol,A项错误;B项,Na2S和Na2O2的摩尔质量都是78g/mol,15.6gNa2S和Na2O2以任意比混合,n总=
CH3COOCH2CH3+H2O,由于该反应为可逆反应,生成的CH3COOCH2CH3物质的量小于0.5mol,A项错误;B项,Na2S和Na2O2的摩尔质量都是78g/mol,15.6gNa2S和Na2O2以任意比混合,n总=![]() =0.2mol,Na2S和Na2O2中阴、阳离子个数比都为1:2,含有阴离子物质的量为0.2mol,B项正确;C项,n(Zn)=
=0.2mol,Na2S和Na2O2中阴、阳离子个数比都为1:2,含有阴离子物质的量为0.2mol,B项正确;C项,n(Zn)=![]() =0.5mol,Zn与浓H2SO4的反应为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,随着反应的进行H2SO4变稀,Zn与稀H2SO4的反应为:Zn+H2SO4=ZnSO4+H2↑,Zn无论与浓硫酸反应还是与稀硫酸反应,生成气体分子物质的量等于Zn的物质的量,生成气体分子物质的量为0.5mol,C项正确;D项,MnO2与浓盐酸共热制Cl2的反应中,Cl元素的化合价由-1价升至0价,生成1molCl2转移电子物质的量为2mol,D项正确;答案选A。
=0.5mol,Zn与浓H2SO4的反应为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,随着反应的进行H2SO4变稀,Zn与稀H2SO4的反应为:Zn+H2SO4=ZnSO4+H2↑,Zn无论与浓硫酸反应还是与稀硫酸反应,生成气体分子物质的量等于Zn的物质的量,生成气体分子物质的量为0.5mol,C项正确;D项,MnO2与浓盐酸共热制Cl2的反应中,Cl元素的化合价由-1价升至0价,生成1molCl2转移电子物质的量为2mol,D项正确;答案选A。


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:
【题目】已知:SO3的相对分子质量是M,一个氧原子的质量是ag,一个硫原子中有b个中子,则一个硫原子的质子数是(阿伏伽德罗常数用NA表示)( )
A.M﹣3aNA﹣b
B.M﹣3aNA+b
C.[(M÷NA)﹣3a﹣b]
D.[M÷(3a﹣b)NA]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 纳米材料是指一种称为“纳米”的新物质制成的材料
B. 复合材料有强度高、质量轻、耐高温、耐腐蚀等性能,其综合性质超过单一材料
C. 光导纤维是以二氧化硅为主要原料制成的
D. 合成纤维的主要原料是石油、天然气、煤等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6 mol L-1。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为( )(反应前后溶液体积变化忽略不计)
A. 0.225 mol L-1 B. 0.30 mol L-1 C. 0.36 mol L-1 D. 0.45 mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图,两电极上发生的电极反应分别为:a极:Ag++e-=Ag b极:Fe-2e-=Fe2+
下列说法正确的是( )
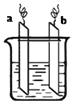
A. a极材料一定为金属银
B. b极一定连电源的正极
C. 装置中电解质溶液阳离子一定只含有Ag+
D. 装置中发生的反应方程式一定是Fe +2Ag+===Fe2++2Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.若已知: Cu(OH)2 (s) ![]() Cu2+ (aq)+2OH—(aq) △H= akJ/mol
Cu2+ (aq)+2OH—(aq) △H= akJ/mol
H2O(l) ![]() H+(aq) + OH—(aq) △H= bkJ/mol
H+(aq) + OH—(aq) △H= bkJ/mol
请写出Cu2+发生水解反应的热化学方程式________________________________,该反应的平衡常数为_______,已知:25℃时, Ksp[Cu(OH)2]=2.0×10-20 mol3/L3
II.室温下,现有①0. 2 mol/L NaOH溶液、②0.2 mol/L HX溶液,两溶液等体积混合后,测得溶液pH=8则:
(1)上述混合液中各离子浓度由大到小的顺序为_______________________
(2)pH=12的NaOH溶液与pH=2的HX等体积混合,混合后溶液显______性(填“酸”、“碱”或“中”)。
III. NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图。

该电池在使用过程中正极反应为:O2+4e-+2N2O5=4NO3—,石墨I电极上生成氧化物Y,其电极反应为:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是制造光电池的一种原料,人体缺少硒就会得“克山病”。从电解精炼铜的阳极泥中提取硒的流程如下,已知阳极泥中硒以Se、Ag2Se、Cu2Se等形式存在:

请回答下列问题:
(1)电解精炼铜时,粗铜与电源的_____(填“正极”或“负极”)相连。
(2)SeO2溶于水得到H2SeO3(Ka1=3.5×10-3,Ka2=5.0×10-8),常温下亚硒酸溶液与少量氢氧化钠溶液反应的离子方程式为:_________________,反应所得的盐形成的溶液pH____7,(填>、<或=)原因是________________________________(用相关数据及必要的文字说明)
(3)亚硒酸溶液与SO2反应制硒的化学方程式为_____________________________。电解亚硒酸溶液可制得强酸H2SeO4,则电解时的阴极反应式为________________。
(4)上述硒的提取过程中除了焙烧过程中浓硫酸有强烈的腐蚀性外,还存在的主要问题是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图1所示装置制备KClO溶液,并通过KClO溶液与FeCl3溶液的反应制备高效水处理剂K2FeO4。
已知K2FeO4具有下列性质: ①可溶于水,微溶于饱和KOH溶液;②在0~5℃的强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
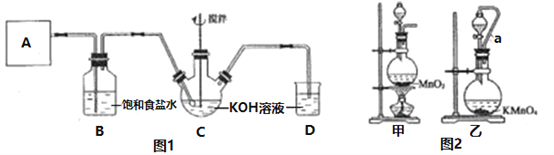
回答下列问题:
(1)装置A用于产生氯气,若选用图2中的甲装置,反应的离子方程式是________,若选用装置乙,其中的导管a的作用是________。
(2)Cl2与KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,控制反应在0~5℃进行。实验中可采取的措施是________;在通入氯气的过程中,不断搅拌的目的是_____________。
(3)制备K2FeO4时,KClO饱和溶液与FeCl3饱和溶液的混合方式为______,反应的离子方程式是____________。
(4)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将K2FeO4粗产品溶于冷的3mol/LKOH溶液中________(填操作名称),将滤液置于冰水浴中,再加入______,搅拌、静置、再过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com