
某已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为25%,B的焰色反应呈黄色,C、J、X是同周期的元素的简单氢化物,X为无色液体,C、J为气体,D是一种不溶于水的白色固体。反应生成的水均已略去。它们有如下图所示的关系。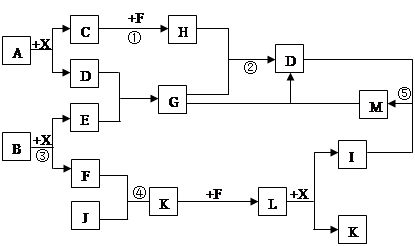
(1)写出化学式:A ,E ,L ;
(2)在反应①②③④⑤中属于氧化还原反应的是 ;
(3)反应③化学方程式为: ;
(4)写出下列离子方程式:反应② ;
G溶液与M溶液的反应 。
(1)Al4C3;NaOH;NO2 (各2分,共6分)(2)①③④(3分)
(3)2Na2O2+2H2O=4NaOH+O2↑ (2分)(4)2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-(2分)
(或AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-); Al3++3AlO2-+6H2O = 4Al(OH)3↓(2分)
解析试题分析:X为无色液体,推断X为H2O;B的焰色反应为黄色,则B中含有钠元素。由于B与水反应生成两种物质,则B应该是过氧化钠,E和F为氢氧化钠和氧气。C、J、X是同周期的元素的简单氢化物,C、J为气体,且F与J反应,因此F是氧气,则E是氢氧化钠。D是一种不溶于水的白色固体能与氢氧化钠反应,因此D是氧化铝或氢氧化铝。D与E反应生成G,而G与H反应又生成D,所以D应该是氢氧化铝,G是偏铝酸钠。C与氧气的反应物H能与偏铝酸钠反应生成氢氧化铝,因此H可能是CO2,所以C是甲烷,A为碳与铝的化合物,结合给出的质量分数,A为Al4C3,它与水发生水解反应Al4C3+12H2O=4Al(OH)3+3CH4↑;C、J、X是同周期的元素的简单氢化物,C、J为气体,且J与氧气也反应,所以J是氨气,与氧气反应生成NO和水,则K是NO,NO与氧气反应生成NO2,所以L是NO2,二氧化氮溶于水生成NO和硝酸,因此I是硝酸。硝酸与氢氧化铝反应生成硝酸铝和水,即M是硝酸铝,硝酸铝与偏铝酸钠反应又产生氢氧化铝沉淀。
(1)根据以上分析可知A、E、L的化学式分别为Al4C3;NaOH;NO2 ;
(2)有元素化合价升降的反应是氧化还原反应,因此在反应①②③④⑤中属于氧化还原反应的是①③④;
(3)反应③化学方程式为2Na2O2+2H2O=4NaOH+O2↑;
(4)反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-(或AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-);G溶液与M溶液的反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓。
考点:考查无机物推断


科目:高中化学 来源: 题型:填空题
我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。生产流程如下: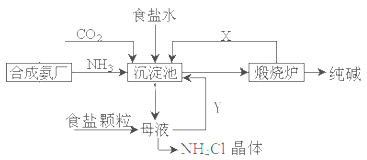
(1)完成有关反应的化学方程式
①沉淀池: NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
②煅烧炉:
(2)联合制碱法的优点表述中,不正确的是___________
A.生产原料为:食盐、NH3、CO2
B.副产物氯化铵可做氮肥
C.生产过程中可循环利用的物质只有CO2
D.原料利用率高
某实验小组,利用下列装置模拟“联合制碱法”的第一步反应。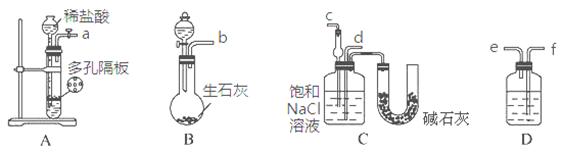
(3)上述装置中接口连接顺序为 ;
A.a接c;b接f、e接d B.a接d;b接f、e接c
C.b接d;a接e、f接c D.b接c;a接f、e接d
(4)D中应选用的液体为 。
为测定产品纯碱的成分和含量,做如下实验。假设产品纯碱中只含NaCl、NaHCO3杂质。
(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加 试剂。
(6)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用c mol/L的HCl溶液滴定至溶液由红色变为无色(指示CO32- +H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCl溶液总体积为V2 mL。则纯碱样品中NaHCO3质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式: ,反应后得到的溶液呈 色。用此溶液分别做如下实验:
(1)取少量溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为 ,此反应属于 (填反应类型)。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈 色,即制得Fe(OH)3胶体。
(3)取另一只小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到 烧杯中的液体产生丁达尔效应。这个实验可以用来区别 。
(4)用Fe(OH)3胶体进行下列实验:
①将其装入U形管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色加深,这说明 ,这种现象称为 。
②向其中加入饱和(NH4)2SO4溶液发生的现象是 ,原因是 。
③向其中滴入过量稀硫酸,现象是 ,其原因是 。
④提纯此分散系常用的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是 ;Y与过量浓硝酸反应后溶液中含有的盐的化学式为 。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是 。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下: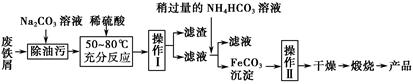
回答下列问题:
①操作Ⅰ的名称是 ;操作Ⅱ的名称是 ;操作Ⅱ的方法为 。
②请写出生成FeCO3沉淀的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。写出生成Fe2+所有可能的离子反应方程式: 。若要确认其中有Fe2+,应选用 (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应的化学方程式为: 。然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422
℃,沸点1366 ℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42—等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如下: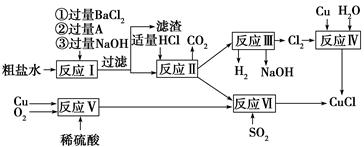
(1)A的化学式为________。
(2)写出反应Ⅴ的化学方程式______________________________________
(3)写出反应Ⅵ的离子方程式______________________________________
(4)本工艺中可以循环利用的物质是(用化学式表示)___________________________
(5)反应Ⅵ后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃ 燥2小时,冷却,密封包装即得产品。于70 ℃真空干燥的目的是_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用足量的CO还原14 g铁的氧化物的混合物,将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则这种混合物组成是①FeO、Fe2O3 ②FeO、Fe3O4 ③Fe2O3、Fe3O4中的 ,其物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下: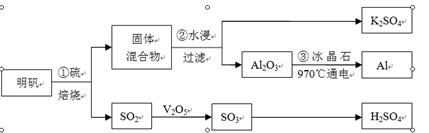
明矾焙烧的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是 。
(2)步骤②中,为提高浸出率,可采取的措施有 。
| A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以硫铁矿烧渣(含有氧化铁和少量硫化亚铁、二氧化硅等)为原料制备聚铁{可表示为Fe2(OH)n(SO4)3-n/2,和绿矾(FeSO4.7H2O)具有成本低、反应快、产品质量高等优点。制备流程如下图: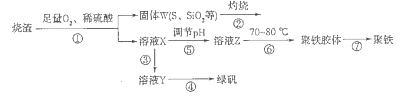
(1)流程图中溶液X为Fe(SO4)3,溶液,据此写出操作①中属于氧化还原反应的离子方程式:____________。
(2)操作②的处理存在弊端,该弊端是_____________。若固体W与KOH溶液昆合加热,其中一个反应的化学方程式为3S+6KOH 2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
(3)操作③需要加入的物质(试剂)是_________,目的是___________________________。
(4)操作⑤是使溶液pH___________(填“增大”或“减小”)。
(5)操作⑥控制温度为70 -80℃的目的是_________________________________________ 。
(6)双氧水在酸性环境(硫酸)中是一种强氧化剂,可以将硫酸亚铁氧化成三价铁,制得Fe2(OH)n(SO4)3-n/2,反应的化学方程式为__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com