
下列无色溶液中,各组离子能大量共存的是()
A. Ca2+、K+、Cl﹣、NO3﹣ B. Ag+、Na+、NO3﹣、Cl﹣
C. Cu2+、K+、SO42﹣、Cl﹣ D. Ba2+、NH4+、SO42﹣、Cl﹣
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
列叙述错误的是()
A. NH3的喷泉实验说明氨气极易溶于水
B. NO 和NH3均可用排空气法收集
C. 盛液溴的瓶内加少量水可防止液溴的挥发
D. NH3遇到挥发性的强酸就能冒白烟
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为含有同一种元素的a、b、c、d、e五种物质的转化关系.其中a是单质,b是气态氢化物,c、d是氧化物,e是该元素最高价氧化物对应的水化物,则a可能是()
①C②N2③S④F2.
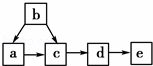
A. 只有①和③ B. 只有④ C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生将一小块钠投入滴有酚酞的水中,此实验能证明钠下面4点性质中的()
①钠比水轻
②钠的熔点较低
③钠与水反应在时要放出热量
④钠与水反应后溶液呈碱性.
A. ①④ B. ①②④ C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
制备氯化物时,常用两种方法:①用金属与氯气直接化合制得;②用金属与盐酸反应制得.用以上两种方法都可制得的氯化物是()
A. AlCl3 B. FeCl3 C. FeCl2 D. CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
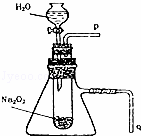
用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.
(1)由实验现象所得出的有关Na2O2和H2O反应的结论是 (填序号)
a.反应放热 b.棉花在空气中可以自燃
c.有O2生成 d.Na2O2在空气中可以自燃
(2)写出Na2O2和H2O反应的化学方程式 .
(3)某校研究性学习小组拟用如图装置进行实验,以证明上述结论.为验证得到的气体产物所进行实验操作方法及现象是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
将Mg条、Al条平行插入一定浓度的NaOH溶液中,用导线、电流计连接成原电池,此电池工作时,下列叙述中正确的是()
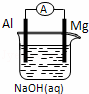
A. Mg比Al活泼,Mg 失去电子被氧化成Mg2+
B. 负极反应式为:Al+4OH﹣﹣3e﹣=AlO2﹣+2H2O
C. 该电池的内外电路中,电流均是由电子定向移动形成的
D. Al是电池阴极,开始工作时溶液中会立即有白色沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
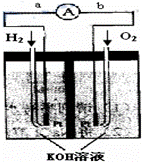
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示).
(2)负极反应式为 .
(3)电极表面镀铂粉的原因为增
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ.2Li+H2 2LiHⅡ.LiH+H2O═LiOH+H2↑
2LiHⅡ.LiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是Li,反应Ⅱ中的氧化剂是H2O.
②用锂吸收224L(标准状况)H2,再由生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 .
③若改用熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极.已知负极的电极反应是CH4+4CO32﹣﹣8e﹣=5CO2+2H2O.则正极的电极反应是 .为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,此电池工作时必须有部分A物质参加循环,则A物质的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 增大压强,活化分子数增加,化学反应速率一定增大
B. 升高温度,活化分子百分数增加,化学反应速率一定增大
C. 活化分子间所发生的分子间的碰撞为有效碰撞
D. 加入反应物,使活化分子百分数增加,化学反应速率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com