
(5分)钛(Ti )被称
为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。
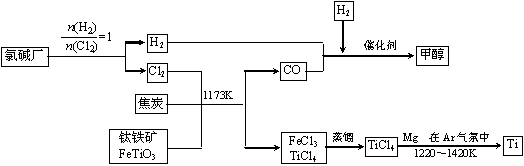
在上述产业链中,合成96 t甲醇理论上需额外补充H2 t (不考虑生产过程中物质的任何损失,要写出计算过程)。
选做题(本题分A、B两题,考生只要选择其中一题作答。若两题都作答,则以A题得分计入总分。本题共12分)
科目:高中化学 来源: 题型:阅读理解
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)在光照条件下,氯气和氢气反应过程如下:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl
反应②中被破坏的化学键是——,氯元素的原子结构示意图为——。。
(2)二氧化氯(ClO2)是一种广泛用于水处理消毒剂,与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有害的有机氯化物。制备ClO2的方法有以下两种:
2NaClO3+4HCl===2ClO2↑+Cl2+2NaCl+2H2O…………………………①
2NaClO2+H2O2+H2SO4===2C1O2↑+O2↑+Na2SO4+2H2O …………………②
你认为哪种方法最佳 (填序号),理由是 。
(3)工业上用电解饱和食盐水的方法制取烧碱和氯气,请写出反应的离子方程式
。
(4)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)![]()
![]() WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t??2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t??2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
或“等于”或“小于”)

②从反应开始到t1时间内的平均反应速率
v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是![]()
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(5)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是 ,溶液中离子浓度由大到小的顺序是 [不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(6)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl(g)==MgCl2(s)△H=—641kJ/mol
②Ti(s)+2Cl2(g)===TiCl2(l) △H=—770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)在光照条件下,氯气和氢气反应过程如下:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl
反应②中被破坏的化学键是——,氯元素的原子结构示意图为——。。
(2)二氧化氯(ClO2)是一种广泛用于水处理消毒剂,与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有害的有机氯化物。制备ClO2的方法有以下两种:
2NaClO3+4HCl===2ClO2↑+Cl2+2NaCl+2H2O…………………………①
2NaClO2+H2O2+H2SO4===2C1O2↑+O2↑+Na2SO4+2H2O …………………②
你认为哪种方法最佳 (填序号),理由是 。
(3)工业上用电解饱和食盐水的方法制取烧碱和氯气,请写出反应的离子方程式
。
(4)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)![]()
![]() WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
或“等于”或“小于”)
②从反应开始到t1时间内的平均反应速率
v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是![]()
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(5)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是 ,溶液中离子浓度由大到小的顺序是 [不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(6)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl(g)==MgCl2(s)△H=—641kJ/mol
②Ti(s)+2Cl2(g)===TiCl2(l) △H=—770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:山东省枣庄市2010届高三年级调研考试理综(化学部分)试题 题型:填空题
(14分)
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)在光照条件下,氯气和氢气反应过程如下:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl
反应②中被破坏的化学键是——,氯元素的原子结构示意图为——。。
(2)二氧化氯(ClO2)是一种广泛用于水处理消毒剂,与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有害的有机氯化物。制备ClO2的方法有以下两种:
2NaClO3+4HCl===2ClO2↑+Cl2+2NaCl+2H2O…………………………①
2NaClO2+H2O2+H2SO4===2C1O2↑+O2↑+Na2SO4+2H2O …………………②
你认为哪种方法最佳 (填序号),理由是 。
(3)工业上用电解饱和食盐水的方法制取烧碱和氯气,请写出反应的离子方程式
。
(4)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)
 WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
或“等于”或“小于”)

②从反应开始到t1时间内的平均反应速率
v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(5)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是 ,溶液中离子浓度由大到小的顺序是 [不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(6)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl(g)==MgCl2(s)△H=—641kJ/mol
②Ti(s)+2Cl2(g)===TiCl2(l) △H=—770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:0110 模拟题 题型:填空题




查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com