
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 3mol单质Fe在纯氧中完全燃烧,失去8NA个电子
B. 1molCu和足量热浓硫酸充分反应可生成NA个SO3分子
C. 标准状况下,22.4L N2和H2的混合气体中含有NA个原子
D. 78g Na2O2中含共价键数目为2NA个
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含有少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜。回答下列问题:

(1)甲烷燃料电池负极的电极反应式为_____________________。
(2)乙装置中阳离子通过X膜向________ 极(填“Fe”或“C”)移动,写出乙装置中的石墨电极上的电极方程式____________________________________。
(3)若在标况下,有2.24L氧气参与反应,则乙装置中右侧溶液________(填“增加”或“减少”)______g,丙装置中CuSO4浓度__________(填“增加”、“减少” 或“不变”);若将乙装置两侧溶液混合,常温下加水稀释至体积为4 L,则此时溶液液的pH=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,常温下,有氧化还原反应(未配平):HFeO4-+(NH2)2CS+H2O→Fe(OH)3+(NH2)2CO+SO42-+OH,下列有关说法正确的是
A. HFeO4-为还原剂,Fe(OH)3为氧化产物
B. 氧化剂与还原剂反应的物质的量之比为4∶3
C. 随着反应的进行,溶液中c(H+)/Kw逐渐变小
D. 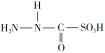 为此反应的中间产物,其中碳元素的化合价为0价
为此反应的中间产物,其中碳元素的化合价为0价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。所发生的转化过程为CH3CH2CH2CH2OH![]() CH3CH2CH2CHO。
CH3CH2CH2CHO。

反应物和产物的相关物理性质如表所示。
性质 | 沸点/℃ | 密度/g·cm-3 | 水中溶解性 |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以上的馏分。将馏出物倒入分液漏斗中,分去水层,将有机层干燥后蒸馏,收集75~77℃馏分,产量为2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加入浓硫酸中,说明理由:___________。
(2)加入沸石的作用是___________,若加热后发现未加入沸石,应采取的正确措施是___________。
(3)上述装置图中,B仪器的名称是____,D仪器的名称是_______。
(4)将正丁醛粗产品置于分液漏斗中分离水时,水在______(填“上”或“下”)层。
(5)反应温度应保持在90~95℃,其原因是______________________。
(6)本实验中,正丁醛的产率为_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于某些离子的检验及结论一定正确的是
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的甲烷(CH4)和二氧化碳物质的量之比为__________,原子总数之比为__________,密度之比为__________。
(2)在标准状况下,4 g H2、11.2 L O2、1 mol H2O中,所含分子数最多的是__________,质量最大的是__________,体积最小的是__________。
(3)标况下,1.92 g 某气体的体积为 672 mL,则此气体的相对分子质量为_____。
(4)已知某硫酸溶液的密度为 1.84 g/cm3,质量分数为 98%,则该硫酸的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响,原理如下:
(1)![]()
![]()
(2)![]()
![]()
实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。
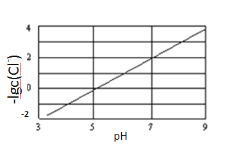
下列说法正确的是( )
A. 溶液pH越大,Ksp(CuCl)增大
B. 反应达到平衡时增大c(Cu2+),c(Cl-)减小
C. 该过程中,Cu+起到了催化剂的作用
D. 从反应自发性角度分析,如反应(2)能自发进行,则b>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe(NO3)3、Cu(NO3)2、HNO3的某种稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示。下列说法错误的是( )
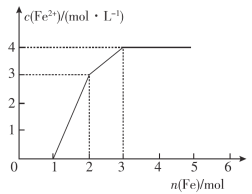
A.横轴0~1:Fe+NO![]() +4H+==Fe3++NO↑+2H2O
+4H+==Fe3++NO↑+2H2O
B.横轴1~2:Fe+2Fe3+=3Fe2+
C.横轴2~3:Fe+Cu2+=Fe2++Cu
D.原溶液中三种溶质浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是化工合成中最重要的镍源,在实验室中模拟工业上利用金属镍废料(含镍、铁、铝)生产氯化镍晶体
是化工合成中最重要的镍源,在实验室中模拟工业上利用金属镍废料(含镍、铁、铝)生产氯化镍晶体![]() 流程如下:
流程如下:

下表列出了相关金属离子生产氢氧化物沉淀的pH:
氢氧化物 |
|
|
|
|
开始沉淀的pH | 7.6 | 2.7 | 7.1 | 3.7 |
沉淀完全的pH | 9.6 | 3.7 | 9.2 | 4.7 |
回答下列问题:
(1)加入![]() 氧化时发生反应的离子方程式为________________________,调pH的范围为____________,若调
氧化时发生反应的离子方程式为________________________,调pH的范围为____________,若调![]() ,则溶液中
,则溶液中![]() _______________。(已知
_______________。(已知![]() ,
,![]() )
)
(2)滤液A的溶质主要是______________________。
(3)操作①的实验方法依次是_____________、_____________、过滤、洗涤、干燥,操作②的实验方法是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com