
| A. | 分子式为SiO2 | B. | 熔化时共价键断裂 | ||
| C. | 属于酸性氧化物 | D. | 1mol SiO2中含有4 mol Si-O键 |
分析 A.二氧化硅晶体是由硅原子和氧原子构成的原子晶体,不含分子;
B.二氧化硅是原子晶体,熔化时破坏Si-O键;
C.二氧化硅能与强碱溶液反应生成盐和水;
D.在二氧化硅晶体中,每个硅原子形成四条Si-O键.
解答 解:A.二氧化硅晶体是由硅原子和氧原子构成的原子晶体,不含分子,因此没有分子式,故A错误;
B.二氧化硅是原子晶体,熔化时破坏共价键Si-O键,故B正确;
C.二氧化硅能与强碱溶液反应生成盐和水,属于典型的酸性氧化物,故C正确;
D.在二氧化硅晶体中,每个硅原子形成四条Si-O键,1mol SiO2中含有4 mol Si-O键,故D正确;
故选A.
点评 本题主要考查了二氧化硅晶体结构,二氧化硅晶属于原子晶体,难度不大,掌握原子晶体的结构是解题的关键.


科目:高中化学 来源: 题型:选择题
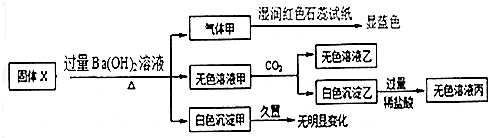
| A. | 气体甲一定是纯净物 | |
| B. | 白色沉淀乙不一定是Al(OH)3 | |
| C. | 固体X中一定存在 (NH4)2SO4、MgCl2、AlCl3 | |
| D. | 固体X中一定存在FeCl2、AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低碳生活就是节能减排,使用太阳能等代替化石燃料,可减少温室气体的排放 | |
| B. | 新能源的优点主要是资源丰富、可再生、没有或很少有污染 | |
| C. | 氢能的优点热值高、资源丰富、燃烧产物无污染;缺点是储存和运输困难 | |
| D. | 高纯度的硅单质广泛用于制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | BaCl2+K2SO4═BaSO4↓+2KCl | B. | BaCO3+H2SO4═BaSO4↓+CO2↑+H2O | ||
| C. | Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 | D. | Ba(OH)2+2KHSO4═BaSO4↓+K2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
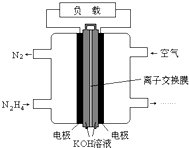 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述不正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述不正确的是( )| A. | 电流从右侧电极经过负载后流向左侧电极 | |
| B. | 负极发生的电极反应式为N2H4+4OH--4e-=N2+4H2O | |
| C. | 该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 | |
| D. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X溶液 | 固体Y | Z溶液 | 现象 |  |
| A | 稀硫酸 | 亚硫酸氢钠 | 品红试剂 | 品红褪色 | |
| B | 浓氨水 | CaO | 紫色石蕊试液 | 溶液变红 | |
| C | 盐酸 | 石灰石 | 硅酸钠溶液 | 出现白色沉淀 | |
| D | 双氧水 | MnO2 | 氢硫酸溶液 | 产生浑浊 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3易溶于水形成胶体 | |
| B. | CuSO4溶液可观察到丁达尔现象 | |
| C. | Fe(OH)3胶体可观察到丁达尔现象 | |
| D. | 胶体分散系中所有粒子的直径都在1~1000 nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.
苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.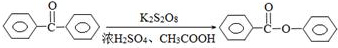
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com