
| A. | 各元素的最高正化合价跟族的序数相等 | |
| B. | 所有元素都有正化合价和负化合价,它们的绝对值之和等于8 | |
| C. | 非金属元素的负化合价,等于原子最外层达到8个电子稳定结构所需得到的电子数 | |
| D. | 各元素原子的最外层电子数跟族序数相等 |
分析 A.O、F没有正化合价;
B、O、F没有正化合价;
C、非金属元素的负化合价,等于原子最外层达到8个电子稳定结构所需得到的电子数;
D、主族元素原子的最外层电子数=族序数;
解答 解:A、O、F没有正化合价,故A错误;
B、O、F没有正化合价,则不满足最高正化合价和它的负化合价的绝对值之和等于8,故B错误;
C、非金属元素的负化合价,等于原子最外层达到8个电子稳定结构所需得到的电子数,故C正确;
D、主族元素原子的最外层电子数=族序数,如Na最外层有1个电子,则族序数为1,即主族元素原子的最外层电子数等于其所在族的族序数,故D错误;
故选C.
点评 本题考查元素周期律,题目难度不大,熟悉元素在周期表中的位置及元素的性质即可解答,注重元素位置与性质的考查.


科目:高中化学 来源: 题型:解答题
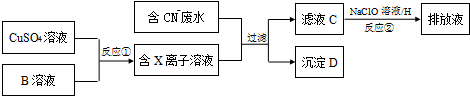
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数为2的元素 | |
| B. | 原子序数为48的元素 | |
| C. | 原子核外L层比M层多一个电子的元素 | |
| D. | 原子核外M层有8个电子的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

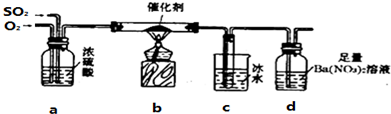

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低QkJ | B. | 低2QkJ | C. | 高QkJ | D. | 高2QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:5:4 | B. | 2:1:2 | C. | 1:1:1 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com