
�������糧�ͷų������ĵ������NOx������������Ͷ�����̼���������ɻ������⡣��ȼú���������������������̼�ȴ�������ʵ����ɫ���������ܼ��š��������õ�Ŀ�ġ�
��1�����������ü������ԭNOx��
CH4��g�� �� 4NO2��g�� ��4NO��g�� �� CO2��g�� �� 2H2O��g�� ��H1����574 kJ��mol��1
CH4��g�� �� 4NO��g�� ��2N2��g�� �� CO2��g�� �� 2H2O��g�� ��H2����1160 kJ��mol��1
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ ��
��2����̼����CO2ת��Ϊ�״���CO2��g����3H2��g�� CH3OH��g����H2O��g����
CH3OH��g����H2O��g����
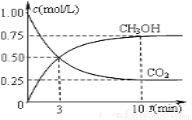
�����Ϊ1L�Ĺ̶��ݻ����ܱ������г���1 mol CO2��3 mol H2����������Ӧ�����CO2��CH3OH��g��Ũ����ʱ��仯����ͼ��ʾ���Իش�
��0��10 min�ڣ�������ƽ����Ӧ����Ϊ___________mol/��L��min����
������ѡ����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ��
A��v��H2��=3v��CO2��
B�������������ܶȲ���
C����λʱ���ڣ��γ�2molC=O��ͬʱ����3molH��H
D���������¶Ȳ���
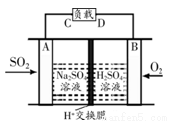
��3��������ѧ������������ͼ��ʾװ����ԭ���ԭ����SO2ת��Ϊ��Ҫ�Ļ���ԭ�ϣ�A��B�Ƕ��Ե缫������������ĵ缫Ϊ____����A��B��ʾ����A���ĵ缫��ӦʽΪ_ ___��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�������ʡ�����Ͽ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ��ƶ���
�л���������E��H��һ�������ºϳɣ������������Ϣ����������⣺

��AΪ�����Һ˴Ź���������2�ֲ�ͬ��ѧ��������
��
��һ��̼ԭ�������������ǻ����ȶ�������ˮ�γ��ʻ�
��1��B�ķ���ʽΪ ��
��2��A��B��C��D�ķ�Ӧ����Ϊ �� ��
��3�������廯����F�ķ���ʽΪC7H8O, �����ϵ�һ�ȴ���ֻ�����֣���F�Ľṹ��ʽΪ ��
��4��D����E�Ĺ����ТٵĻ�ѧ����ʽΪ  ��
��
E��H��Ӧ����I�ķ���ʽΪ ��
��5��I��ͬϵ��K��Է���������IС28��K�Ľṹ����ͬʱ���������������ٱ�����ֻ������ȡ�������ڷ����в����������� �֣������������칹������д������ͬ���칹��������һ������NaOH�����л���ṹ��ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�߶��Ͽ�ѧ����ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ���ǣ� ��
A����һ�������£���ϩ����H2�����ӳɷ�Ӧ����������H2�����ӳɷ�Ӧ
B��C2H6O��C4H10����2��ͬ���칹��
C���������������������NaOH��Ӧ�����߷����й�������ͬ
D�����ۺ͵����ʾ���ˮ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�갲��ʡ�߶�����ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��ɫ��Һ�������������е������֣�H+��NH4+��Fe3+��Ba2+��Al3+��CO32�C��Cl�C��OH�C��NO3�C�������Һ�м������ۣ�ֻ�ų�H2������Һ���ܴ������ڵ����������
A��3�� B��4�� C��5�� D��6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�갲��ʡ�߶�����ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Һ�д������������������ӣ�NO3-��SO42-��Fe3����H����M�������ʵ���֮��Ϊn��NO3-����n��SO42-����n��Fe3������n��H������n��M����2��3��1��3��1���� M����Ϊ
A��Fe2�� B��Ba2�� C��Mg2�� D��CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ��һ���ʼ컯ѧ�Ծ��������棩 ���ͣ�ѡ����
�ڱ�״����CH4��HCl��H2S��NH3��Ϊ���塣�ڱ�״���·ֱ��Т�13��44L CH4 ��1molHCl���� ��27��2gH2S ��2��408��1023��NH3���ӣ�����˵����ȷ���ǣ� ��
A��������ڣ��ۣ��ܣ��� B���ܶȣ��ڣ��ۣ��٣���
C���������ڣ��ۣ��ܣ��� D��Hԭ�Ӹ������٣��ۣ��ܣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�걱���ж������߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ������
���ᣨH3BO3��Ϊ��ɫ��ĩ״�ᾧ���������ڲ�����ҵ�����Ը��Ʋ�����Ʒ�����ȡ������ܣ����еǿ�ȣ���������ʱ�䡣���������Ҫ�ɷ�ΪMg2B2O5��H2O��Fe3O4����������Fe2O3��FeO��Al2O3��SiO2�ȣ�Ϊԭ���Ʊ�����Ĺ����������£����ֲ����������ԣ���
I�����������м������ϡH2SO4�����ˣ�
������Һ�м������˫��ˮ���ٵ�����Һ��pHԼΪ5��
���ˣ���������Һ����Ũ������ȴ�ᾧ�����˵ô�����ͺ�þ�ε�ĸҺ��
���������ᾫ�Ƶ����ᡣ
��֪�������������������pH
Al��OH��3 | Fe��OH��2 | Fe��OH��3 | Mg��OH��2 | |
��ʼ����ʱ | 3.8 | 5.8 | 2.2 | 10.6 |
��ȫ����ʱ | 4.7 | 8.3 | 4��0 | 12 |
ע���������ӵ���ʼŨ��Ϊ0��01 mol��L-1
��ش�
��1��д��Mg2B2O5��H2O�����ᷴӦ�Ļ�ѧ����ʽ��___________��
��2��Ϊ��߲���I�еķ�Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ��_________________��д����������
��3��������Ŀ����_______________________��
��4���������ᡱ�е���Ҫ������ ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�걱���ж������߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£�����1 mL pH=13�İ�ˮ�������ж���ȷ���ǣ� ��
A����ҺŨ��Ϊ0.1 mol/L
B��ϡ����100 mLʱ��pH=11
C����������NH4Cl���壬c��OH-������
D����������NaOH���壬c��NH4+����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�����ϵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
2005��10��12�ա��������š���˳�������10��17�յķ��أ������ҹ������˺��켼����
������ͻ���ԵĽ�չ���ɴ���Һ̬N2H4��Һ̬NO2Ϊȼ�ϣ�ȼ�����ɵ�����ˮ����ʱ�����¶ȿɴ�2700�档��֪N2��g�� + 2O2��g��= 2NO2��g������H = +67��7kJ/mol��
N2H4��g �� + O2��g��= N2��g�� + 2H2O��g������H=-534kJ/mol
��N2H4��NO2��Ӧ��˵������ȷ����
A��ȼ��ʱNO2��������
B���������������������ǻ�ԭ����
C������1molN2ת��8mole-
D���÷�Ӧ���Ȼ�ѧ����ʽ�ǣ�2N2H4��g��+ 2NO2��g��=3N2��g�� + 4H2O��g������H=-1135��7kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com