
| A. | Fe片 | B. | 蔗糖 | C. | 固体NaCl | D. | 熔融的CuCl2 |
分析 在水溶液里或熔融状态下能导电的化合物是电解质,能导电的物质中含有自由电子或离子,据此分析解答,
A.铁片为金属单质,能导电,既不是电解质也不是非电解质;
B.蔗糖是有机物,不能电离出离子,水溶液或熔融状态不能导电,是非电解质;
C.氯化钠固体不能导电,在水溶液中或熔融状态下能够导电,是电解质;
D.熔融的氯化铜能导电,是电解质.
解答 解:A、铁片能导电,但铁片是单质不是化合物,所以铁片不是电解质也不是非电解质,故A错误.
B、蔗糖在水溶液里或熔融状态都以分子分子,所以都不导电,蔗糖是非电解质,故B错误;
C、氯化钠溶液中含有自由移动的阴阳离子所以能导电,氯化钠固体是电解质,但本身不能导电,故C错误;
D、熔融的CuCl2中含有自由移动的离子,所以能导电,CuCl2是能导电的电解质,故D正确;
故选D.
点评 本题考查电解质的概念及物质的导电性,难度不大.要注意电解质必须是化合物,导电是在水溶液或熔化状态下为条件.


科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 苯和溴水混合后加入铁粉 | 制溴苯 |
| B | 向工业酒精中加入无水硫酸铜 | 确定工业酒精中是否含有水 |
| C | 电石与水反应,制得的气体直接通入酸性KMnO4溶液 | 检验制得的气体是否为乙炔 |
| D | 将氯乙烷与NaOH溶液共热后冷却,再滴入AgNO3溶液 | 检验氯乙烷中的氯原子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
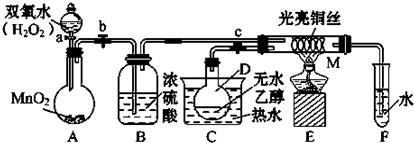
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 酪氨酸既能与盐酸反应又能与NaOH溶液反应 | |
| B. | 对羟苯丙酮酸分子中有2种含氧官能团 | |
| C. | 1 mol尿黑酸最多可与含1 mol NaOH的溶液反应 | |
| D. | 可用溴水鉴别对羟苯丙酮酸与尿黑酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
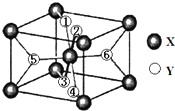 在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物.氢化物晶体的结构有共价型和离子型之分.
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物.氢化物晶体的结构有共价型和离子型之分.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 大型飞机的发动机被誉为航空工业皇冠上的“宝石”.制造过程中通常采用碳化钨做关键部位的材料
大型飞机的发动机被誉为航空工业皇冠上的“宝石”.制造过程中通常采用碳化钨做关键部位的材料查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将15.6 g Na2O2和5.4 g Al同时放入一定量的水中可以产生标况下气体6.72 L | |
| B. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该气体能使品红溶液褪色,则该溶液可能既含有SO32-又含有CO32- | |
| C. | 大多数碳的化合物都是共价化合物,其原因是碳元素有三种同位素 | |
| D. | 石油分馏可获得乙烯、丙烯和丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
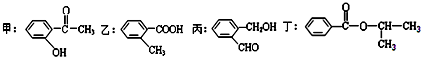
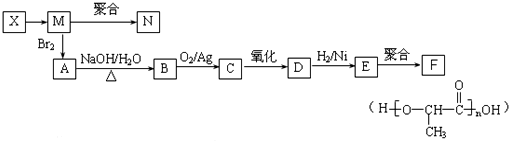
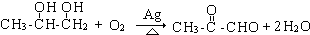 .
.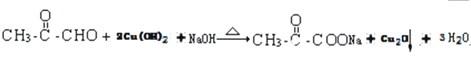 .
. .
.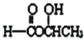 、
、 、
、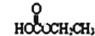 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40K和40Ca 具有相同的中子数 | |
| B. | 40K+和40Ca2+ 具有相同的电子层结构 | |
| C. | 39K和40Ca互为同位素 | |
| D. | 40K的原子半径小于40Ca 的原子半径 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com