

| 4.0×10-38 |
| (1.0×10-6)3 |


科目:高中化学 来源: 题型:
| A、第6周期,ⅣA族 |
| B、第7周期,ⅣA族 |
| C、第6周期,ⅢA族 |
| D、第7周期,ⅢA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:

283 116 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
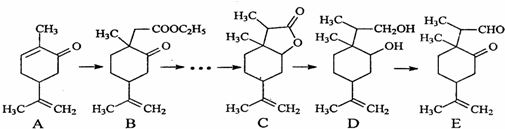
| CH3I |
| 催化剂 |
| LiBH4 |
| THF |
| LiBH4 |
| THF |
| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
A Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

A、 用系统命名法可命名为邻氨基苯磺酸 用系统命名法可命名为邻氨基苯磺酸 |
| B、对氨基苯磺酸、酒石酸都能发生加成反应和取代反应 |
| C、对氨基苯磺酸、酒石酸的核磁共振氢谱中都有三种峰 |
| D、1 mol酒石酸分别和足量钠、碳酸氢钠反应,都能产生2 mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列关于“瘦肉精”的说法中正确的是( )
下列关于“瘦肉精”的说法中正确的是( )| A、摩尔质量为313.5 g |
| B、属于芳香烃 |
| C、分子式为C12H19Cl3N2O |
| D、不能发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com