
分析 (1)亚硫酸钠溶液与二氧化硫反应生成亚硫酸氢钠,据此书写化学方程式;
(2)由题目信息可知,SO2与NaCl等物质生成硫酸钠和Cl2,根据S、O原子比例关系可知,应有氧气参与反应,配平书写化学方程式;
(3)三硅酸镁中和胃酸(HCl)生成氯化镁和硅酸,反应的化学方程式为:Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O,根据题意,被氢氧化钠中和的盐酸的物质的量为0.003mol,所以与三硅酸镁反应的盐酸为0.005mol-0.003mol=0.002mol,根据化学方程式,列比例式可计算出n的值.
解答 解:(1)煤中含有S,与氧气反应生成SO2,反应方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,“饱和亚硫酸钠溶液吸收法”中SO2与Na2SO3反应生成NaHSO3,反应方程式为:SO2+Na2SO3+H2O═2NaHSO3,
故答案为:SO2+Na2SO3+H2O═2NaHSO3;
(2)由题目信息可知,SO2与NaCl等物质生成硫酸钠和Cl2,根据S、O原子比例关系可知,应有氧气参与反应,反应化学方程式为:2NaCl+SO2+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+Cl2,
故答案为:2NaCl+SO2+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+Cl2;
(3)三硅酸镁中和胃酸(HCl)生成氯化镁和硅酸,反应的化学方程式为:Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O,根据题意,被氢氧化钠中和的盐酸的物质的量为0.003mol,所以与三硅酸镁反应的盐酸为0.005mol-0.003mol=0.002mol,根据化学方程式,设0.184gMgSi3O8•nH2O的物质的量是x,
Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O
1 4
x 0.002mol
则:$\frac{1}{x}$=$\frac{4}{0.002mol}$,
解得:x=0.0005mol,所以MgSi3O8•nH2O的摩尔质量是:$\frac{0.184}{0.0005}$g/mol=368g/mol,
Mg2Si3O8的摩尔质量为260g/mol,则:18n=108,解得:n=6.
故答案为:Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O;6.
点评 本题考查较为综合,涉及化学方程式书写、复杂化学式计算等知识,题目难度中等,明确化学方程式的书写原则为解答关键,试题有利于提高学生的分析、理解能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
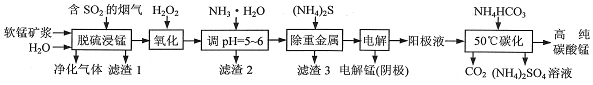
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验台上的易燃、易爆药品要远离火源 | |
| B. | 如果浓硫酸沾到皮肤上应迅速用抹布擦去,再用大量水冲洗,最后涂上小苏打溶液 | |
| C. | 少量碱液滴到实验台上,用湿抹布擦干净,再用水冲洗 | |
| D. | 一旦发现实验室里出现火灾情况,应立即报告学校领导,然后向119报警 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应达到平衡状态后,改变外界条件后,若反应速率发生变化,则平衡一定发生移动 | |
| B. | 大多数化学反应在一定条件下都有一定限度 | |
| C. | 使用催化剂可降低反应活化能,加快反应速率,改变反应限度 | |
| D. | FeCl3溶液与KSCN溶液反应达到平衡时,加入少量KCl溶液,因K+、Cl-一直在溶液中存在,所以溶液颜色不会变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合气体中O2和CH4的体积比为2:1 | |
| B. | 残留物中只有Na2CO3和NaOH | |
| C. | 反应中电子转移总数为0.8NA | |
| D. | 残留物质量为26.6克 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2 $\stackrel{光}{→}$ CH3Cl+HCl | |
| B. | CH2═CH2+HBr-→CH3CH2Br | |
| C. | CH3COOH+CH3CH2OH$→_{△}^{H_{2}SO_{4}}$CH3COOCH2CH3+H2O | |
| D. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
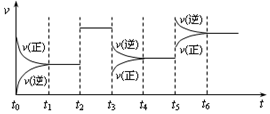
| A. | t2时增加了X的浓度 | B. | t3时增大了压强 | ||
| C. | t5时升高了温度 | D. | t4~t5时间内转化率最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应不需要加热就能发生 | |
| B. | 升高温度或加入催化剂,均可以改变化学反应的反应热 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | |
| D. | 物质发生化学变化,一定伴随着能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
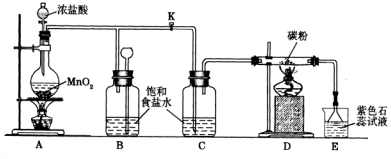
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com