
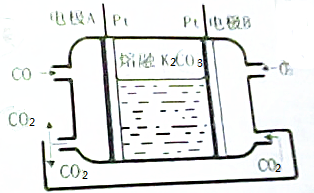
 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )| 待测气体 | 部分电极反应产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
| A. | 上述气体检测时,敏感电极均作电池正极 | |
| B. | 检测Cl2时,敏感电极上发生还原反应 | |
| C. | 检测H2S时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 检测分别含H2S和CO体积分数相同的两份空气样本时,传感器上产生电流大小相同 |
分析 A.失电子发生氧化反应的电极是负极、得电子发生还原反应的电极是正极;
B.检测氯气时,氯气得电子生成氯离子;
C.检测硫化氢时,硫化氢生成硫酸,硫元素发生氧化反应,则其所在电极为负极;
D.产生的电流大小与失电子多少有关;
解答 解:A.失电子发生氧化反应的电极是负极、得电子发生还原反应的电极是正极,根据待测气体和反应产物可知,部分气体中元素化合价上升,部分气体中元素的化合价下降,所以敏感电极不一定都做电池正极,故A错误;
B.检测氯气时,氯气得电子生成氯离子,电极反应式为Cl2+2e-═2Cl-,发生还原反应,故B正确;
C.检测硫化氢时,硫化氢生成硫酸,硫元素化合价由-2价变为+6价而发生氧化反应,则其所在电极为负极,正极上氧气得电子和氢离子反应生成水,电极电极反应式为O2+4H++4e-═2H2O,故C错误;
D.产生的电流大小与失电子多少有关,检测H2S和CO体积分数相同的两份空气样本时,硫化氢失去电子数大于CO,所以产生电流大小不同,故D错误;
故选B.
点评 本题考查了原电池原理,根据元素化合价变化确定正负极,正确判断正负极是解本题关键,难点是电极反应式的书写,注意产生电流与相同物质的量的物质得失电子多少有关,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
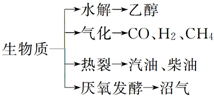 “地沟油”被称为“生物燃料”,该燃料属于生物质能.已知生物质的主要转化途径及主要产物如图所示.则下列关于生物燃料以及生物质能的说法中正确的是( )
“地沟油”被称为“生物燃料”,该燃料属于生物质能.已知生物质的主要转化途径及主要产物如图所示.则下列关于生物燃料以及生物质能的说法中正确的是( )| A. | ①②③④⑤ | B. | ①②④⑤ | C. | ③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某恒密闭容器中,一定量的X与Y发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述中正确的是( )
某恒密闭容器中,一定量的X与Y发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述中正确的是( )| A. | 反应温度T1>T2该反应是吸热反应 | |
| B. | 该反应进行到M点放出的热量大于进行到W点放出的热量 | |
| C. | M点的平衡常数比W点的平衡常数小 | |
| D. | M点时再加入一定量的X,平衡后X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸凝胶经干燥脱水后得到“硅胶”,常用作干燥剂,也可以用作催化剂的载体 | |
| B. | 金属表面形成的氧化物都能起到保护内层金属的作用 | |
| C. | 煤与氢气作用生成液体燃料,也可以间接液化,先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇 | |
| D. | 含氮和磷的大量污水任意排放向近海海域会出现水华、赤潮等污染问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
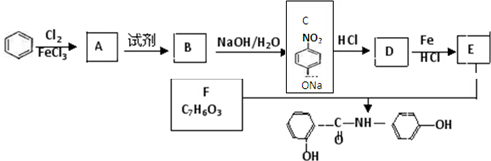
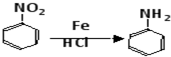
 .
. .
. 、
、 、
、 (任选两种)(写出各种结构).
(任选两种)(写出各种结构).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
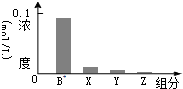 室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )| A. | 溶液显中性 | B. | 升温,c(X)增大,c(Y)减小 | ||
| C. | c(B+)+c(Y)=c(Cl-) | D. | 稀释溶液,c(X)增大,c(Z)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
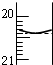 氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001000mol/L酸性KMnO4溶液和10.00mL未知浓度的无色NaHSO3溶液,反应的离子方程式是:
氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001000mol/L酸性KMnO4溶液和10.00mL未知浓度的无色NaHSO3溶液,反应的离子方程式是:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.
;A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com