
| �� | |||
| �� | �� |

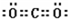 ��
��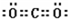 �����ۼ���HClO4��H2SO4��H2CO3��S2-��Cl-��
�����ۼ���HClO4��H2SO4��H2CO3��S2-��Cl-��
| ||
| �� |
| ||
| �� |
| ||
| ||


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
1L��Һ�к����������ӣ���Pt�缫������Һ������·����3mol e-ͨ��ʱ�����Ե��ʱ��Һ����ı仯���缫������ܴ��ڵ��ܽ���������˵����ȷ���ǣ�������
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �л���A������ʳƷ��ҵ����֪9.0g A������O2�г��ȼ�գ������ɵĻ����������ͨ��������Ũ����ͼ�ʯ�ң��ֱ�����5.4g��13.2g��������ʣ������ΪO2��
�л���A������ʳƷ��ҵ����֪9.0g A������O2�г��ȼ�գ������ɵĻ����������ͨ��������Ũ����ͼ�ʯ�ң��ֱ�����5.4g��13.2g��������ʣ������ΪO2��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com