
| A. | 氯原子: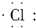 | B. | OH-离子: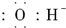 | ||
| C. | NH3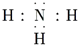 | D. | HCl的形成过程: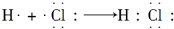 |
分析 A、氯原子的最外层有7个电子;
B、电子式是用原子的最外层电子表示出来的式子;
C、氨气分子中氮原子最外层达到8电子稳定结构;
D、氢原子和氯原子通过共用电子对形成HCl;
解答 解:A、氯原子的最外层有7个电子,故氯原子的电子式为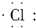 ,故A正确;
,故A正确;
B、氢氧根离子为阴离子,O原子周围8个电子,其电子式为 ,故B错误;
,故B错误;
C、氨气分子中氮原子最外层达到8电子稳定结构,漏掉了氮原子的一对孤电子对,氨气的电子式为 ,故C正确;
,故C正确;
D、氢原子和氯原子通过共用电子对形成HCl,用电子式表示HCl的形成过程: ,故D正确.
,故D正确.
故选B.
点评 本题主要考查学生电子式的书写、用电子式表示化合物的形成过程,考查全面,注重基础,题目难度中等.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:选择题
 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚( 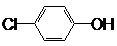 ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )| A. | b为电池的正极,发生还原反应 | |
| B. | 电流从b极经导线、小灯泡流向a极+2e-+H+=Cl-+ | |
| C. | a极的电极反应式为: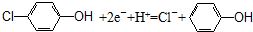 | |
| D. | 当外电路中有0.2mole-转移时,a极区增加的H+的个数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔分子的比例模型  | B. | 溴乙烷的电子式: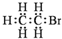 | ||
| C. | 2-氯丙烷的结构简式:CH3CHClCH3 | D. | 丙烯的键线式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
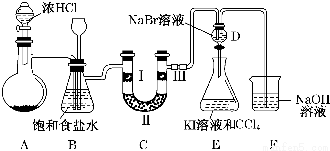
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水,酒精和水,植物油和水 | |
| B. | 四氯化碳和水,溴苯和水,硝基苯和水 | |
| C. | 甘油和水,乙酸和水,乙酸和乙醇 | |
| D. | 汽油和水,苯和甲苯,己烷和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
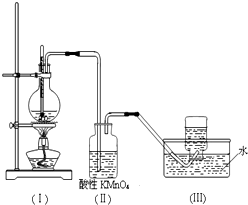 如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后观察到烧瓶中溶液变黑,装置(Ⅱ)中经硫酸酸化的高锰酸钾溶液褪色.
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后观察到烧瓶中溶液变黑,装置(Ⅱ)中经硫酸酸化的高锰酸钾溶液褪色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
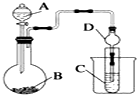 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com