
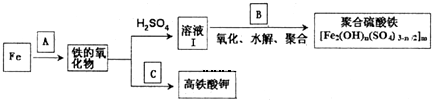
分析 (1)Fe与水蒸气反应生成四氧化三铁与氢气;
(2)Fe元素化合价由+3价升高为+6价,共升高3价,N元素化合价由+5价降低为+3价,共降低2价,化合价升降最小公倍数为6,则Fe2O3的系数为1、KNO3的系数为3,根据原子守恒配平,可知缺项物质为水;
(3)①碘单质遇到淀粉显示蓝色,可选淀粉为指示剂;当碘单质完全反应后溶液由蓝色变为无色;
②根据反应:2Fe3++2I-═2Fe2++I2、I2+2S2O32-═2I-+S4O62-,可得关系式Fe3+~S2O32-,然后根据关系式计算出铁离子的物质的量,再计算铁元素的总含量;
双氧水可以将I-氧化为I2,导致消耗S2O32-的偏多;
(4)根据电子转移守恒计算.
解答 解:(1)Fe与水蒸气反应生成四氧化三铁与氢气,反应方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)Fe元素化合价由+3价升高为+6价,共升高3价,N元素化合价由+5价降低为+3价,共降低2价,化合价升降最小公倍数为6,则Fe2O3的系数为1、KNO3的系数为3,根据原子守恒配平,可知缺项物质为水,配平后方程式为:Fe2O3+3 KNO3+4KOH=2K2FeO4+3KNO2+2H2O,
故答案为:1、3、4、2、3、2H2O;
(3)①碘单质遇到淀粉显示蓝色,可选淀粉为指示剂;当加入最后一滴硫代硫酸钠溶液时,蓝色消失且半分钟不变色说明反应到达终点,
故答案为:淀粉溶液;当加入最后一滴硫代硫酸钠溶液时,蓝色消失且半分钟不变色;
②由关系式Fe3+~S2O32-,则n(Fe3+)=n(S2O32-)=0.1000mol/L×0.02L=0.002mol,铁元素总含量为:$\frac{56g/mol×0.002mol}{0.02L}$=5.6g/L;
H2O2也能氧化I-生成I2,所以若过氧化氢没有除尽,则消耗硫代硫酸钠溶液体积偏大,所测结果偏高,
故答案为:5.6;偏高;
(4)K2Cr2O7溶液的物质的量浓度为cmol/L,根据电子转移守恒,则:
0.025L×cmol/L×6=$\frac{3.48g}{232g/mol}$×$\frac{1}{3}$×1
解得c=0.033,
故答案为:0.033mol/L.
点评 本题考查物质的制备方案的设计、氧化还原反应配平、化学计算等知识,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液 | B. | 溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2能使湿润的有色布条褪色,所以Cl2具有漂白性 | |
| B. | 红热的铁丝在Cl2中剧烈燃烧,反应生成FeCl3 | |
| C. | 利用溴单质的氧化性可以把碘离子转化为碘单质 | |
| D. | 实验室常用NaOH溶液吸收多余的Cl2以避免污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
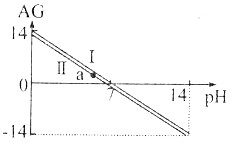
| A. | AG与pH的关系一定是AG=14-2pH | |
| B. | 直线Ⅰ和Ⅱ是因溶液的温度不同引起的,且T(Ⅰ)>T(Ⅱ) | |
| C. | AG=0时,溶液一定呈中性 | |
| D. | a点的溶液中可以有大量Na+、Cl-、Fe3+存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中Cu2+与Fe2+的物质的量比为1:2 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 氧化性:Zn2+>Cu2+>Fe3+>Ag+ | |
| D. | 1 mol Fe可还原2 mol Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应A(s)=B(s);△H<O,则说明A物质比B物质稳定 | |
| B. | Zn(s)+CuSO4 (aq)═ZnSO4 (aq)+Cu(s);△H=-216kJ•mol-1.则反应物总能量<生成物总能量 | |
| C. | 101kPa时,2H2(g)+O2(g)═2H2O(l);△H=-QkJ•mol-1,则H2的燃烧热为$\frac{1}{2}$QkJ•mol-l | |
| D. | H+(aq)+OH- (aq)=H2O(l);△H=-57.3 kJ•mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com