
二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)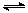 CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)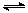 CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)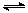 CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)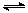 CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有 。
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是 。
(4)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g) 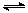 CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 。
A.△H <0
B.P1<P2<P3
C.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%[
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为 。
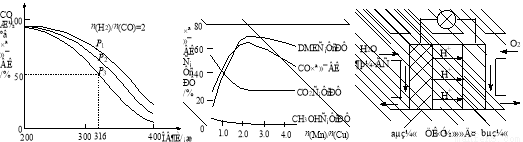
图1 图2 图3
(7)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,
CH3 HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 。
(1)-246.1 (2)AC
(3)消耗了反应②的H2O(g)有利于反应②正向进行,同时生成了H2
(4)A (5)2.0
(6)CH3OCH3-12e-+3H2O=2CO2↑+12H+
(7)H2SO4腐蚀设备或有硫酸废液产生
【解析】
试题分析:(1)根据盖斯定律,通过①*2+②+③可得反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H=-246.1 kJ·mol-1。(2)根据改反应特点,下列措施中,A.使用过量的CO,相当于增大反应物浓度,平衡右移。 B.升高温度,平衡左移。C.增大压强,平衡右移。故 能提高CH3OCH3产率的有AC。(3)反应③能提高CH3OCH3的产率,原因是消耗了反应②的H2O(g)有利于反应②正向进行,同时生成了H2。(4)两种反应物,当增加一种物应物的量浓度时必将会增大另一物质的转化率。起始时n(H2)/n(CO)=3,比原来投入量比值为2时,氢气的浓度增大,故平衡时CO转化率要大于50%。答案选A。(5)观察图2可知催化剂中n(Mn)/n(Cu)约为2时,二甲醚的选择性最高。(6)从图3中看出,a电极是氢离子离开的一极,应该是负极,失电子,二甲醚要在此极上失去电子变成二氧化碳,根据电苛守恒,电极反应式为CH3OCH3-12e-+3H2O=2CO2↑+12H+。(7)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,CH3 HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是H2SO4腐蚀设备或有硫酸废液产生。
CH3OCH3(g)+CO2(g)的△H=-246.1 kJ·mol-1。(2)根据改反应特点,下列措施中,A.使用过量的CO,相当于增大反应物浓度,平衡右移。 B.升高温度,平衡左移。C.增大压强,平衡右移。故 能提高CH3OCH3产率的有AC。(3)反应③能提高CH3OCH3的产率,原因是消耗了反应②的H2O(g)有利于反应②正向进行,同时生成了H2。(4)两种反应物,当增加一种物应物的量浓度时必将会增大另一物质的转化率。起始时n(H2)/n(CO)=3,比原来投入量比值为2时,氢气的浓度增大,故平衡时CO转化率要大于50%。答案选A。(5)观察图2可知催化剂中n(Mn)/n(Cu)约为2时,二甲醚的选择性最高。(6)从图3中看出,a电极是氢离子离开的一极,应该是负极,失电子,二甲醚要在此极上失去电子变成二氧化碳,根据电苛守恒,电极反应式为CH3OCH3-12e-+3H2O=2CO2↑+12H+。(7)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,CH3 HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是H2SO4腐蚀设备或有硫酸废液产生。
考点:本题考查盖斯定律的运用,图像的分析处理,电极反应式的书写和化工原理的分析。


科目:高中化学 来源:2014高考化学专题突破训练 专题2化学常用计量 溶液练习卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.在1 L 0.1 mol/L硫化钠溶液中阴离子总数大于0.1NA
B.1 mol O2作氧化剂时转移电子数一定为4NA
C.标准状况下,22.4 L戊烷所含分子数为NA
D.在1 L 1.0 mol/L NaCl溶液中含有NA个NaCl分子
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题10非金属及其化合物练习卷(解析版) 题型:实验题
某化学探究小组欲对SO2的化学性质进行如下探究,请你帮助他完成实验报告。
物质 | 类别 | 化学性 质预测 | 实验验证 | ||
实验操作 | 实验现象 | 实质(用离子 方程式表示) | |||
二氧 化硫 | 酸性 氧化物 | 与水 反应 | 将盛满SO2气体的试管倒立在水中,并测定试管中溶液的pH | ① | SO2+H2O
|
与碱 反应 | ② | 出现白 色沉淀 | ③ | ||
(2)该探究小组还根据SO2中S元素的化合价,预测并通过实验探究SO2的其他性质。探究过程中选用的实验药品有:浓硫酸、亚硫酸钠固体、Na2S溶液、酸性高锰酸钾溶液、品红溶液等。探究过程的实验装置图如图所示,请回答下列问题。
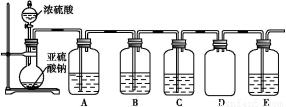
①请你完成下列表格。
装置 | 药品 | 作用 |
A |
| 验证二氧化硫的还原性 |
B |
|
|
C | 品红溶液 |
|
②A中发生反应的离子方程式为 。
③实验时C中的实验现象是 。
④D装置的作用是 。E是尾气处理装置,有人认为E装置中可以加入足量的Ba(NO3)2溶液,你认为是否合理,请结合离子方程式加以说明: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题10非金属及其化合物练习卷(解析版) 题型:选择题
如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O。对实验现象的“解释或结论”正确的是( )
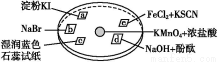
选项实验现象解释或结论
Aa处变蓝,b处变红棕色氧化性:Cl2>Br2>I2
Bc处先变红,后褪色氯气与水生成了酸性物质
Cd处立即褪色氯气与水生成了漂白性物质
De处变红色还原性:Fe2+>Cl-
查看答案和解析>>
科目:高中化学 来源:2014江苏省扬州市届高三上学期期末考试化学试卷(解析版) 题型:选择题
向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g) 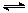 xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:

容器 | 甲 | 乙 |
容积(L) | 0.5 | 0.5 |
反应放热(kJ) | Q1 | Q2 |
反应物起始量 | 1 molA 1 molB | 0.5 molA 0.5 molB |
下列说法正确的是
A.x=1
B.Q1>2Q2
C.根据题中信息无法计算a值
D.保持其他条件不变,起始时向乙容器充入0.2 mol A、0.2 mol B、0.2 mol C,则此时v(正)> v(逆)
查看答案和解析>>
科目:高中化学 来源:2014江苏省扬州市届高三上学期期末考试化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-=2MnO2↓+3SO42-+2H2O
B.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++CO2↑+H2O
C.向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl-
D.向新制Cu(OH)2中加入乙醛溶液并加热:
CH3CHO+2Cu(OH)2+OH-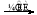 CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习5-3微粒间相互作用力与物质多样性练习卷(解析版) 题型:选择题
下列物质中,既含有离子键又含有极性共价键的是( )
A.Na2O2 B.MgCl2 C.HCl D.NH4Cl
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-2 食品中的有机化合物练习卷(解析版) 题型:选择题
下列说法正确的是( )
①植物油和裂化汽油都可以使溴水褪色 ②葡萄糖、油脂和蛋白质都能发生水解反应 ③按汽油、煤油、柴油的顺序,含碳量逐渐增加 ④防腐剂福尔马林(含甲醛)可用作食品保鲜剂 ⑤乙醇、乙酸、乙酸乙酯都能发生取代反应
A.①③⑤ B.①②⑤ C.②④⑤ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com