


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:


 ,X可能的结构有
,X可能的结构有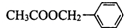 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如:


| Cu |
| △ |
| Cu |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| KOH/室温 |
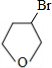





 +NaOH
+NaOH| 水 |
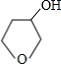 +NaBr
+NaBr +NaOH
+NaOH| 水 |
 +NaBr
+NaBr| 醇 |
| △ |
| 醇 |
| △ |
查看答案和解析>>
科目:高中化学 来源:2009年江苏省宿迁市高考化学冲刺试卷(二)(解析版) 题型:解答题

 ,X可能的结构有______种.
,X可能的结构有______种. )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如:
查看答案和解析>>
科目:高中化学 来源:2009年天津二十中高考化学二模试卷(解析版) 题型:填空题
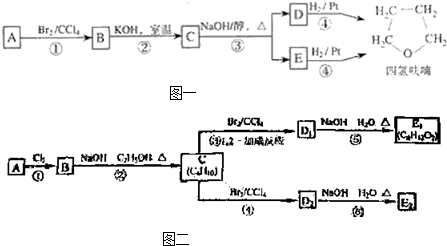
 R-O-R′+HX化合物A经下列四步反应可得到常用溶剂四氢 呋喃,反应框图如图一所示:
R-O-R′+HX化合物A经下列四步反应可得到常用溶剂四氢 呋喃,反应框图如图一所示:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com