
分析 (1)依据N=nNA,结合二氧化碳分子构成解答;
(2)依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$,结合1个水分子含有2个氢原子解答;
(3)依据n=$\frac{V}{Vm}$,结合1个氢气分子含有2个H解答;
(4)依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$,结合1个OH-含有9个质子,10个电子解答;
(5)依据M=$\frac{m}{n}$计算其摩尔质量,摩尔质量以g/mol为单位,数值上等于其相对分子质量;
(6)根据标况下的气体摩尔体积计算出14.2g的物质的量,再根据M=$\frac{m}{n}$,计算出该气体的摩尔质量即可;解题时要注意:摩尔质量的单位为g/mol;
(7)依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算解答;
(8)依据摩尔质量之比等于相对分子质量之比解答.
解答 解:(1)2mol CO2中约含有2NA个分子,含有2mol个碳原子,个数为2NA,含有4mol氧原子;
故答案为:2NA;2NA;4;
(2)9g H2O的物质的量是$\frac{9g}{18g/mol}$=0.5mol,含 0.5NA个H2O,1mol H;
故答案为:0.5mol;0.5NA;1;
(3)标准状况下,2mol H2的体积是2mol×22.4L/mol=44.8L,含有2NA个H2,4NA个H;
故答案为:44.8L;2NA;4NA;
(4)3.01×1023个OH-的物质的量是:$\frac{3.01×10{\;}^{23}}{6.02×1{0}^{23}mol{\;}^{-1}}$=0.5mol,质量为0.5mol×17g/mol=8.5g;含有质子的物质的量是0.5×9=4.5mol,含有电子的物质的量是0.5mol×10=5mol;
故答案为:0.5mol;8.5g;4.5mol;0.5mol;
(5)0.1mol的 Na2X的质量是7.8g,则Na2X的摩尔质量为$\frac{7.8g}{0.1mol}$=78g/mol,X相对原子质量为:78-2×23=32;
故答案为:78g/mol;32;
(6)标准状况下,4.48L该气体的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,所以该气体的摩尔质量为$\frac{14.2g}{0.2mol}$=71g/mol;
故答案为:71g/mol;
(7)若4g O2中含有x个分子,则:$\frac{4g}{32g/mol}$×NA=x;
NA=8x;
故答案为:8;
(8)O2、CH4、H2的相对分子质量之比为:32:16:2,摩尔质量之比:16:8:1;
故答案为:16:8:1.
点评 本题考查了量有关计算,侧重考查微粒个数、物质质量、气体体积的计算,熟悉以物质的量为核心计算公式是解题关键,注意物质的结构组成,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 明矾净水原理不涉及化学变化 | |
| B. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧,说明“纳米铜”的还原性比铜片更强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处理废水中Cr2O72- 的物质量为$\frac{nx}{2}$mol | |
| B. | 消耗绿矾的物质量为n(2-x)mol | |
| C. | 反应中发生转移的电子数为3nx mol | |
| D. | 反应中Cr2O72-被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇燃烧 | B. | 乙烯使溴的四氯化碳溶液褪色 | ||
| C. | 甲烷和氯气混合,见光 | D. | 用乙醇、乙酸与浓H2SO4混合加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
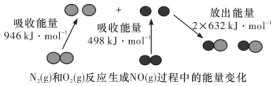 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 在1 L的容器中发生反应,10 min内 N2 减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol/(L•min) | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com